X、Y、Z、R均为短周期元素,X、Y、R同周期,其中R的质子数最大;X、Z同主族.X的原子结构示意图为: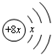 ,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )
,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )
 ,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )
,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )| A.离子半径:X>Z>Y |
| B.Y、Z形成的化合物中只有离子键 |
| C.对应氢化物的沸点:R>Z>X |
| D.Z与X、Y与R形成化合物的晶体类型相同 |
9-10高三·贵州遵义·阶段练习 查看更多[2]
更新时间:2016-12-09 01:20:38
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】W、X、Y、Z为原子序数依次增大的短周期主族元素,W元素可形成密度最小的气体单质; W和Y的最外层电子数相同,可形成离子化合物YW;常温下0.01mol·L-1 X、Z的最高价氧化物对应的水化物溶液的pH值均为2,下列叙述错误的是
| A.原子半径:Y>Z> W |
| B.X、Z分别与W形成的简单化合物相遇会产生白烟 |
| C.XZ3分子中,所有原子的最外层均满足8电子稳定结构 |
| D.W、X和Z形成的化合物中只含有共价键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
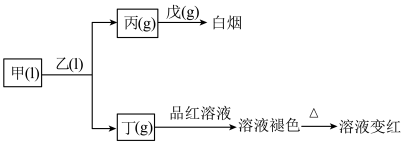
【推荐2】X、Y、Z、W、Q为短周期主族元素,原子序数依次增大且原子序数总和为49。它们的化合物在常温下有如图所示的转化关系:
A.原子半径: 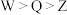 |
B.简单氢化物的沸点: 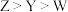 |
| C.化合物W2Q2中含有非极性键和离子键 |
D.最高价氧化物对应水化物的酸性:  |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】W、X、Y、Z为原子序数依次增大的四种短周期元素,W的简单氢化物可用作制冷剂,Y所在周期数与族序数相同,X与Y为同周期元素,Z原子的最外层电子数与W的电子总数相等。下列说法不正确的是
| A.简单离子半径:Z>W>X>Y |
| B.W、X的氢化物在常温下均为气体 |
| C.Y的最高价氧化物的水化物为两性氢氧化物 |
| D.W与Z形成的化合物中只有共价键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】如图是卤素单质( 、
、 、
、 、
、 )的沸点与相对分子质量的关系图,下列说法
)的沸点与相对分子质量的关系图,下列说法不正确 的是
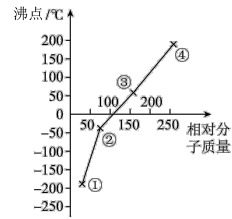
 、
、 、
、 、
、 )的沸点与相对分子质量的关系图,下列说法
)的沸点与相对分子质量的关系图,下列说法
| A.单质①是最活泼的非金属单质 |
| B.单质④的氢化物在卤素氢化物中热稳定性最强 |
| C.保存少量的单质③时加少量水进行水封 |
| D.单质②能使石蕊试液先变红后褪色 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】2022年诺贝尔化学奖授予了点击化学等领域。我国科学家在研究点击反应砌块的过程中,发现了一种结构如图的化合物,X、Y、Z和W是原子序数依次增大的短周期元素,Y和W是同主族元素。下列说法错误的是
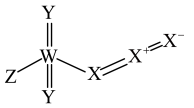
A.简单离子半径: | B.简单氢化物的沸点: |
C.最高价含氧酸的酸性: | D.Y与X、Y与W均能形成多种化合物 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】X、Y、Z、W是四种原子序数依次增大的前20号主族元素,Y原子的最外层电子数为其内层电子数的2倍;Z原子的最外层电子数等于Y原子的核外电子数;W原子的半径是前20号元素中最大的,四种元素原子序数之和为34。下列说法错误的是
| A.X与W为同主族元素 |
| B.Y、Z的单质均有同素异形体 |
| C.X与W形成化合物为离子化合物 |
| D.最简单氢化物的沸点高低:Y>Z |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8。常见元素Z的单质是目前使用量最大的主族金属元素单质,下列说法中不正确的是
| A.因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
| B.沸点:YX3>XW |
| C.化合物YW3遇水能强烈水解,产物之一具有强氧化性 |
| D.离子化合物YX5假如存在。该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】M、X、Y、Z四种短周期主族元素的原子序数依次增大,其中只有X、Y同周期,某盐的电子式如下图所示,该盐可用于检验 。下列说法错误的是
。下列说法错误的是
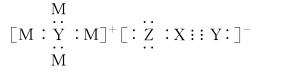
 。下列说法错误的是
。下列说法错误的是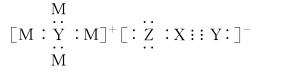
| A.简单离子半径:Z>Y |
| B.Y、Z的简单氢化物均为电解质 |
| C.最高价含氧酸的酸性:Z>X |
| D.M、X可形成原子个数比为1∶1、2∶1和3∶1的化合物 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】 是重要的还原剂,合成方法为
是重要的还原剂,合成方法为 。下列说法正确的是
。下列说法正确的是
 是重要的还原剂,合成方法为
是重要的还原剂,合成方法为 。下列说法正确的是
。下列说法正确的是| A.碱性强弱:LiOH>NaOH | B.半径大小: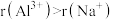 |
| C.熔点:Na>Li | D. 有一个键为配位键 有一个键为配位键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下面的排序不正确的是( )
| A.晶体熔点由低到高:F2<Cl2<Br2<I2 |
| B.熔点由高到低: Na>Mg>Al |
| C.硬度由大到小: 金刚石>碳化硅>晶体硅 |
| D.晶格能由大到小: MgO>CaO>NaF> NaCl |
您最近一年使用:0次

 中含有非极性共价键
中含有非极性共价键

