某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:________________ .
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为_________ .
(3)请完成MnO2和浓盐酸制备Cl2的离子方程式:__________________ .
(4)如果14.2g氯气与足量的氢气反应,然后生成的气体用500mL某浓度的NaOH溶液恰好反应,则此NaOH的浓度为_________ (请写出计算过程)
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl 、OH
、OH 和SO
和SO .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO ;假设3:SO32-、ClO
;假设3:SO32-、ClO 都存在。
都存在。
设计实验方案,进行实验。请在答题卡上写出与实验步骤相应的预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
(1)请完成SO2与过量NaOH溶液反应的化学方程式:
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为
(3)请完成MnO2和浓盐酸制备Cl2的离子方程式:
(4)如果14.2g氯气与足量的氢气反应,然后生成的气体用500mL某浓度的NaOH溶液恰好反应,则此NaOH的浓度为
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl
 、OH
、OH 和SO
和SO .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).①提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO
 ;假设3:SO32-、ClO
;假设3:SO32-、ClO 都存在。
都存在。设计实验方案,进行实验。请在答题卡上写出与实验步骤相应的预期现象和结论。限选实验试剂:3moL
 L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.| 实验步骤 | 预期现象和结论 |
 步骤1:取少量吸收液于试管中,滴加3 moL 步骤1:取少量吸收液于试管中,滴加3 moL L-1H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2:在A试管中滴加紫色石蕊试液 | |
步骤3:在B试管中滴加0.01mol L-1KMnO4 L-1KMnO4 |
11-12高一上·广东梅州·期末 查看更多[1]
(已下线)2010-2011学年广东省梅县东山中学高一上学期期末考试化学试卷
更新时间:2016-12-09 01:31:08
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】以废旧镍氢电池的金属电极芯[主要成分为 和
和 ,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
②酸性条件下的氧化性: >
> 。
。
回答下列问题:
(1)“氧化”时 作
作_____ (填“氧化剂”或“还原剂”,下同),“浸出”时 作
作______ 。
(2)写出“沉钴1”中 转化为
转化为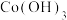 的离子方程式:
的离子方程式:_______ 。
(3)设计“ ”的目的是
”的目的是_______ 。
(4)“沉钴2”中发生反应的离子方程式为_______ ,_______ (填“能”或“不能”)用 替代
替代 ,理由是
,理由是_______ 。
(5)设计实验检验 是否洗净:
是否洗净:_______ 。
(6)水溶液中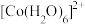 、
、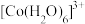 的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能:
的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能: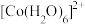
_______ (填“>”“<”或“=”)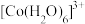 。
。
(7)镍单质晶胞有两种形式,如图所示。已知:图1晶胞棱长为acm,图2中晶胞底边长为bcm,高为ccm。图1、图2(正六棱柱)镍晶体密度之比为_______ 。
 和
和 ,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
| 离子 |  |  |  |  |  |  |
| 开始沉淀的pH | 6.3 | 1.5 | 3.4 | 6.2 | 7.2 | |
| 完全沉淀的pH | 8.3 | 2.8 | 4.7 | 8.9 | 9.2 | 1.1 |
 >
> 。
。回答下列问题:
(1)“氧化”时
 作
作 作
作(2)写出“沉钴1”中
 转化为
转化为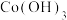 的离子方程式:
的离子方程式:(3)设计“
 ”的目的是
”的目的是(4)“沉钴2”中发生反应的离子方程式为
 替代
替代 ,理由是
,理由是(5)设计实验检验
 是否洗净:
是否洗净:(6)水溶液中
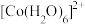 、
、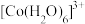 的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能:
的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能: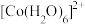
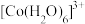 。
。(7)镍单质晶胞有两种形式,如图所示。已知:图1晶胞棱长为acm,图2中晶胞底边长为bcm,高为ccm。图1、图2(正六棱柱)镍晶体密度之比为

您最近一年使用:0次
【推荐2】 是重要的电子工业原料,可用于半导体电子材料、三元电池材料、锰酸锂电池材料、锌锰电池材料、玻璃等的制造。以菱锰矿(主要成分为
是重要的电子工业原料,可用于半导体电子材料、三元电池材料、锰酸锂电池材料、锌锰电池材料、玻璃等的制造。以菱锰矿(主要成分为 ,含
,含 和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备
和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态Mn原子的价电子的轨道表示式为_______ 。
(2)“酸浸”时加快反应速率,提高浸取率可采取的措施有_______ (写两种)。
(3)滤渣2的主要成分为_______ (填化学式)。
(4)福美钠的化学式为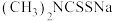 ,其中N、S、Na三种元素的简单离子半径从大到小顺序为
,其中N、S、Na三种元素的简单离子半径从大到小顺序为_______ (填写离子符号)。
(5)已知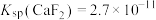 ,
,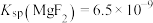 ,当
,当 沉淀完全时(浓度为
沉淀完全时(浓度为 mol⋅L
mol⋅L ),溶液中
),溶液中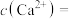
_______ mol⋅L (结果保留三位有效数字)。
(结果保留三位有效数字)。
(6)“沉锰”中生成的 在“氧化”时控制温度为50℃,反应的化学方程式为
在“氧化”时控制温度为50℃,反应的化学方程式为_______ 。
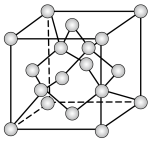
(7) 晶体温度高于1170℃时属于立方晶体,其中
晶体温度高于1170℃时属于立方晶体,其中 与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若
与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若 晶体的晶胞参数为apm,则晶体密度为
晶体的晶胞参数为apm,则晶体密度为_______ g⋅cm-3(列出计算式,阿伏加德罗常数的值为 )。
)。
 是重要的电子工业原料,可用于半导体电子材料、三元电池材料、锰酸锂电池材料、锌锰电池材料、玻璃等的制造。以菱锰矿(主要成分为
是重要的电子工业原料,可用于半导体电子材料、三元电池材料、锰酸锂电池材料、锌锰电池材料、玻璃等的制造。以菱锰矿(主要成分为 ,含
,含 和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备
和少量Fe、Cu、Ni、Ca、Mg等元素)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。 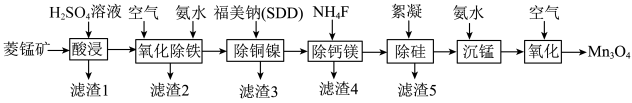
(1)基态Mn原子的价电子的轨道表示式为
(2)“酸浸”时加快反应速率,提高浸取率可采取的措施有
(3)滤渣2的主要成分为
(4)福美钠的化学式为
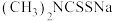 ,其中N、S、Na三种元素的简单离子半径从大到小顺序为
,其中N、S、Na三种元素的简单离子半径从大到小顺序为(5)已知
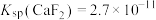 ,
,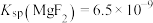 ,当
,当 沉淀完全时(浓度为
沉淀完全时(浓度为 mol⋅L
mol⋅L ),溶液中
),溶液中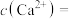
 (结果保留三位有效数字)。
(结果保留三位有效数字)。(6)“沉锰”中生成的
 在“氧化”时控制温度为50℃,反应的化学方程式为
在“氧化”时控制温度为50℃,反应的化学方程式为(7)
 晶体温度高于1170℃时属于立方晶体,其中
晶体温度高于1170℃时属于立方晶体,其中 与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若
与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若 晶体的晶胞参数为apm,则晶体密度为
晶体的晶胞参数为apm,则晶体密度为 )。
)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】FeS是一种黑色固体,常用作固体润滑剂、废水处理剂等。实验室以硫酸亚铁铵[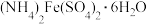 ]和硫代乙酰胺(
]和硫代乙酰胺( )为主要原料,合成纳米FeS。
)为主要原料,合成纳米FeS。
(1)合成纳米FeS的装置如图所示,加入药品前须检查装置气密性,操作方法是_______ 。

(2)将少量的硫酸亚铁铵溶液与硫代乙酰胺混合,加入到三颈烧瓶中。70℃时用NaOH调节混合液pH约为9,有黑色沉淀和能使湿润红色石蕊试纸变蓝的气体产生,同时生成一种醋酸盐,反应的离子方程式为_______ , 的作用是
的作用是_______ ,为提高浸出率可采取的方法是_______ 。
(3)该方法得到的产品中常混有少量 杂质。有研究表明,在混合液中添加少量柠檬酸钠(
杂质。有研究表明,在混合液中添加少量柠檬酸钠( )可降低溶液中
)可降低溶液中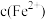 ,抑制
,抑制 杂质的形成。加入柠檬酸钠能降低
杂质的形成。加入柠檬酸钠能降低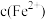 的原因是
的原因是_______ 。
(4)实验所用硫酸亚铁铵[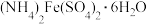 ]可用铁粉为原料制备,已知硫酸亚铁铵是浅绿色晶体,易溶于水,不溶于乙醇。请补充完整实验室制取硫酸亚铁铵晶体的实验过程:取5.6g充分洗净的铁粉,
]可用铁粉为原料制备,已知硫酸亚铁铵是浅绿色晶体,易溶于水,不溶于乙醇。请补充完整实验室制取硫酸亚铁铵晶体的实验过程:取5.6g充分洗净的铁粉,_______ ,向所得溶液中加入 晶体,
晶体,_______ ,低温烘干,得硫酸亚铁铵晶体。(必须使用的试剂: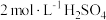 溶液、无水乙醇)
溶液、无水乙醇)
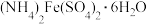 ]和硫代乙酰胺(
]和硫代乙酰胺( )为主要原料,合成纳米FeS。
)为主要原料,合成纳米FeS。(1)合成纳米FeS的装置如图所示,加入药品前须检查装置气密性,操作方法是

(2)将少量的硫酸亚铁铵溶液与硫代乙酰胺混合,加入到三颈烧瓶中。70℃时用NaOH调节混合液pH约为9,有黑色沉淀和能使湿润红色石蕊试纸变蓝的气体产生,同时生成一种醋酸盐,反应的离子方程式为
 的作用是
的作用是(3)该方法得到的产品中常混有少量
 杂质。有研究表明,在混合液中添加少量柠檬酸钠(
杂质。有研究表明,在混合液中添加少量柠檬酸钠( )可降低溶液中
)可降低溶液中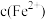 ,抑制
,抑制 杂质的形成。加入柠檬酸钠能降低
杂质的形成。加入柠檬酸钠能降低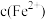 的原因是
的原因是(4)实验所用硫酸亚铁铵[
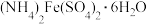 ]可用铁粉为原料制备,已知硫酸亚铁铵是浅绿色晶体,易溶于水,不溶于乙醇。请补充完整实验室制取硫酸亚铁铵晶体的实验过程:取5.6g充分洗净的铁粉,
]可用铁粉为原料制备,已知硫酸亚铁铵是浅绿色晶体,易溶于水,不溶于乙醇。请补充完整实验室制取硫酸亚铁铵晶体的实验过程:取5.6g充分洗净的铁粉, 晶体,
晶体,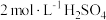 溶液、无水乙醇)
溶液、无水乙醇)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】氯及其化合物在工农业生产和日常生活中用途十分广泛。实验室制备氯气和漂白剂(有效成分为NaClO)的装置如图1所示。
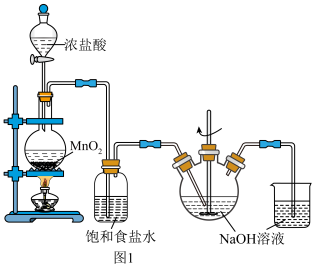
(1)在圆底烧瓶里加入MnO2,通过_______ (填写仪器名称)再加入适量的浓盐酸后加热,发生反应的化学方程式为_______ 。
(2)烧杯中NaOH溶液的作用是_______ 。
(3)设计实验探究反应条件对制备Cl2的影响:
①Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,反应的方程式为_______ 。
②为探究Ⅲ中无明显现象的原因,又设计了实验Ⅳ,如图2所示:
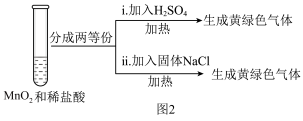
将实验Ⅲ、Ⅳ作对比,得出的结论是_______ 。
(4)实验中发现三颈烧瓶中生成物各物质的量和溶液的温度随时间的变化如图3所示。t1分钟后发生的主要反应的化学方程式为_______ 。

(5)NaClO是一种强氧化剂,有很强的杀菌、漂白作用,还可以用来氧化去除水体中的污染物。
①用NaClO处理废水中水合肼(N2H4•H2O),使其转化成无毒的氮气。写出反应的化学方程式:_______ 。
②NaClO处理高氯(含高浓度Cl-)废水中的有机物时,ClO-将有机物氧化为无毒物质。实验发现,当废水是“酸性”时,NaClO处理高氯废水时,有机物氧化率较低,其原因是_______ 。

(1)在圆底烧瓶里加入MnO2,通过
(2)烧杯中NaOH溶液的作用是
(3)设计实验探究反应条件对制备Cl2的影响:
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和12mol•L-1的浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热MnO2和4mol•L-1的稀盐酸混合物 | 无明显现象 |
②为探究Ⅲ中无明显现象的原因,又设计了实验Ⅳ,如图2所示:

将实验Ⅲ、Ⅳ作对比,得出的结论是
(4)实验中发现三颈烧瓶中生成物各物质的量和溶液的温度随时间的变化如图3所示。t1分钟后发生的主要反应的化学方程式为

(5)NaClO是一种强氧化剂,有很强的杀菌、漂白作用,还可以用来氧化去除水体中的污染物。
①用NaClO处理废水中水合肼(N2H4•H2O),使其转化成无毒的氮气。写出反应的化学方程式:
②NaClO处理高氯(含高浓度Cl-)废水中的有机物时,ClO-将有机物氧化为无毒物质。实验发现,当废水是“酸性”时,NaClO处理高氯废水时,有机物氧化率较低,其原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用酸性高锰酸钾溶液浸湿的脱脂棉。
 请回答下列问题:
请回答下列问题:
(1)装置A、D中发生反应的化学方程式为________________ ;_____________________ 。
(2)实验前欲检查装置A的气密性,可以采取的操作是___________________ ;
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是___________________ (用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为____________________________________ ;
(5)当D中产生__________________ 现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
(6)装置D的作用为________________________________ 。
|
 请回答下列问题:
请回答下列问题:(1)装置A、D中发生反应的化学方程式为
(2)实验前欲检查装置A的气密性,可以采取的操作是
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为
(5)当D中产生
(6)装置D的作用为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】Ⅰ.治理氮氧化物(NOx)的污染是化学研究的重要课题之一、NO能被灼热的铁粉还原为N2,同时生成FeO,利用下列装置模拟该反应。
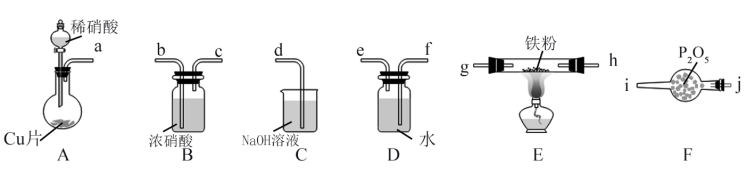
已知:浓硝酸可将NO氧化为NO2;
(1)上述装置接口的连接顺序为:a→_______ →_______ →_______ →_______ →g→h→b→c→d(按气流方向,用小写字母表示)。
(2)装置B的作用是_______ 。
(3)装置E中反应的化学方程式为_______ 。
II.已知(NOx)能与Na2O2反应:NO2和Na2O2都有较强氧化性;Na2O2溶液能与NO2反应,不与NO反应。为探究NO2与Na2O2反应的产物,提出如下假设:假设①NO2氧化Na2O2;假设②Na2O2氧化NO2.甲同学设计如图所示实验装置:
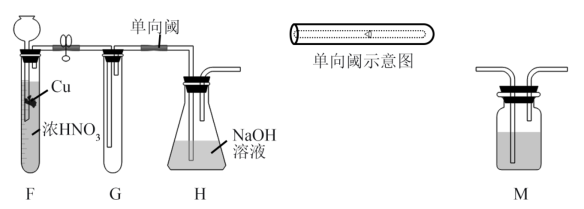
(4)甲乙两同学对假设分别进行了验证:
请做出正确判断,写出NO2和Na2O2反应的化学方程式_______ 。
(5)图中单向阀在实现气体单向流通的同时,还有一个作用是_______ 。

已知:浓硝酸可将NO氧化为NO2;
(1)上述装置接口的连接顺序为:a→
(2)装置B的作用是
(3)装置E中反应的化学方程式为
II.已知(NOx)能与Na2O2反应:NO2和Na2O2都有较强氧化性;Na2O2溶液能与NO2反应,不与NO反应。为探究NO2与Na2O2反应的产物,提出如下假设:假设①NO2氧化Na2O2;假设②Na2O2氧化NO2.甲同学设计如图所示实验装置:

(4)甲乙两同学对假设分别进行了验证:
| 实验操作 | 现象 | 结论 | |
| 甲同学 | 待试管G中收集满气体,向其中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管,观察现象;并将带火星的木条迅速伸进试管,观察。 | 红棕色气体迅速消失;木条复燃 | 假设①正确 |
| 乙同学 | 在F、G之间增加一个M洗气瓶,目的是 | 红棕色气体迅速消失,带火星的木条未复燃 | 假设②正确 |
(5)图中单向阀在实现气体单向流通的同时,还有一个作用是
您最近一年使用:0次



