据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为: Fe2O3(s)+3CH4(g)  2Fe(s)+3CO(g)+6H2(g)
2Fe(s)+3CO(g)+6H2(g)
(1)反应在5 L的密闭容器中进行,2 min 后达到平衡,测得 Fe2O3在反应中质量减少 4.8 g。则该段时间内H2的平均反应速率为______________ ;
(2)将固定质量的 Fe2O3(s)和 CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是______________ ;
(3)FeO 可用CO进行还原,已知:t℃时,FeO(s)+CO(g) Fe(s)+CO2(g) K=0.5
Fe(s)+CO2(g) K=0.5
若在 1 L密闭容器中加入0.04 mol FeO(s),并通入 x mol CO,t℃时反应达到平衡。此时FeO(s)的转化率为 50%,则x=______________ 。
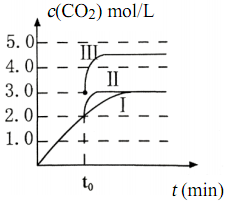
(4)在 3 L容积可变的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是
Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是______________ 。当通过改变压强使曲线 I变为曲线III时,曲线 III达到平衡时容器的体积为_________ L。
 2Fe(s)+3CO(g)+6H2(g)
2Fe(s)+3CO(g)+6H2(g) (1)反应在5 L的密闭容器中进行,2 min 后达到平衡,测得 Fe2O3在反应中质量减少 4.8 g。则该段时间内H2的平均反应速率为
(2)将固定质量的 Fe2O3(s)和 CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是
| A.CH4的转化率等于 CO的产率 |
| B.混合气体的平均相对分子质量不变 |
| C.v 正(CO): v 逆(H2)=1 : 2 |
| D.固体的总质量不变 |
(3)FeO 可用CO进行还原,已知:t℃时,FeO(s)+CO(g)
 Fe(s)+CO2(g) K=0.5
Fe(s)+CO2(g) K=0.5 若在 1 L密闭容器中加入0.04 mol FeO(s),并通入 x mol CO,t℃时反应达到平衡。此时FeO(s)的转化率为 50%,则x=
(4)在 3 L容积可变的密闭容器中发生反应:FeO(s)+CO(g)
 Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是
Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是
更新时间:2016-12-09 08:05:52
|
【知识点】 化学平衡
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】氯化硫酰(SO2C12)主要用作氯化剂。它是一种无色液体,熔点-54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+C12(g) SO2C12 (l) △H=-97.3kJ/mol
SO2C12 (l) △H=-97.3kJ/mol
(1)试写出常温常压下化学平衡常数K的表达式:K=____________ ;若在此条件下,将化学平衡常数K增大,化学反应速率V正也增大,可采取的措施是____________ (选填编号)。
a.降低温度 b.移走SO2C12
c.增加反应物浓度 d.以上都不对
(2)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是___________ (选选填编号)。
a.缩小容器体积 b.使用催化剂
c.增加SO2浓度 d.升高温度
(3)在100℃时,往上述平衡体系中加入37C12,—段时间后,则平衡体系中含有37C1的物质有_______ (选选填编号)。
a.只有37C12 b.只有 SO237Cl2 c. 37C12和SO237Cl2 d.无法判断
(4)下列描述中能说明上述反应已达平衡的是_____________ (选填编号)。
a.v (Cl2) =v (SO2)
b.容器中气体压强不随时间而变化
c.c (Cl2) : c (SO2) =1 : 1
d.容器中气体颜色不随时间而变化
 SO2C12 (l) △H=-97.3kJ/mol
SO2C12 (l) △H=-97.3kJ/mol(1)试写出常温常压下化学平衡常数K的表达式:K=
a.降低温度 b.移走SO2C12
c.增加反应物浓度 d.以上都不对
(2)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是
a.缩小容器体积 b.使用催化剂
c.增加SO2浓度 d.升高温度
(3)在100℃时,往上述平衡体系中加入37C12,—段时间后,则平衡体系中含有37C1的物质有
a.只有37C12 b.只有 SO237Cl2 c. 37C12和SO237Cl2 d.无法判断
(4)下列描述中能说明上述反应已达平衡的是
a.v (Cl2) =v (SO2)
b.容器中气体压强不随时间而变化
c.c (Cl2) : c (SO2) =1 : 1
d.容器中气体颜色不随时间而变化
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇CO(g)+2H2(g)  CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
由表中数据判断ΔH________ 0 (填>、=或<),化学平衡常数表达式K=___________ ;
(2)300 ℃时,在体积为2.0 L的密闭容器中通入2 mol CO和4 mol H2 ,经过20 s 达到平衡状态,
①计算20 s内CO的反应速率为___________ ,此时容器中甲醇的体积分数为_____________ ;
②若向上述平衡体系中同时加入1mol CO,2mol H2 和1mol CH3OH气体,平衡移动情况是__________ (填向右、向左或不移动),原因是_______________ ;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH1=-1277.0 kJ/mol
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g) = H2O(l) ΔH3=-44 kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________________________ ;
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式____________ ;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与____________ 极(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为_____________ 色,当有1.27g 碘单质生成时,需要____________ g CH3OH。

 CH3OH(g) ΔH
CH3OH(g) ΔH(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 3.041 | 1.000 | 0.120 |
(2)300 ℃时,在体积为2.0 L的密闭容器中通入2 mol CO和4 mol H2 ,经过20 s 达到平衡状态,
①计算20 s内CO的反应速率为
②若向上述平衡体系中同时加入1mol CO,2mol H2 和1mol CH3OH气体,平衡移动情况是
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH1=-1277.0 kJ/mol
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g) = H2O(l) ΔH3=-44 kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】催化氧化二氧化硫是 工业制硫酸的主要反应。
Ⅰ:
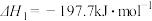 K1(浓度平衡常数)
K1(浓度平衡常数)
为研究该反应,某同学设计了以下三种已装固体 催化剂的密闭容器装置。
催化剂的密闭容器装置。
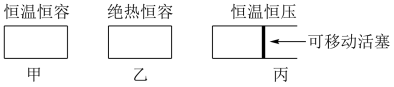
(1)在初始体积与温度相同的条件下,甲、乙、丙中均按2 molSO2、1 molO2投料,达平衡时,三个容器中 的转化率从大到小的顺序为
的转化率从大到小的顺序为________________ (用“甲、乙、丙”表示)。
(2)在容器丙中,0.1 MPa下,在不同温度或不同投料方式下研究上述反应得到数据如下表。
①表中:a=____________ ;b=____________ 。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则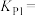
____________ ;
____________ 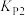 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
③451℃下,若按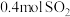 、
、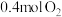 、
、 进行投料,则反应开始时
进行投料,则反应开始时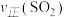
____________ 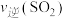 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(3)将上述固体催化剂 换成
换成 气体,同样可以起到催化作用,此催化过程如下:
气体,同样可以起到催化作用,此催化过程如下:
Ⅱ: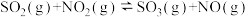
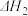
 (浓度平衡常数)
(浓度平衡常数)
Ⅲ:
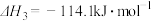
 (浓度平衡常数)
(浓度平衡常数)
则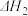 =
=____________ ,
____________ (用含有 、
、 的表达式表示)。
的表达式表示)。
Ⅰ:

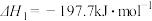 K1(浓度平衡常数)
K1(浓度平衡常数)为研究该反应,某同学设计了以下三种已装固体
 催化剂的密闭容器装置。
催化剂的密闭容器装置。
(1)在初始体积与温度相同的条件下,甲、乙、丙中均按2 molSO2、1 molO2投料,达平衡时,三个容器中
 的转化率从大到小的顺序为
的转化率从大到小的顺序为(2)在容器丙中,0.1 MPa下,在不同温度或不同投料方式下研究上述反应得到数据如下表。
| 实验序号 | A组 | B组 | C组 |
| 反应温度 | 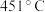 | 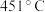 | 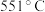 |
| 反应物投入量 | 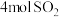 、 、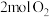 | 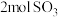 |  、 、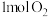 |
| 含硫化合物的转化率 | 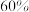 | b | c |
| 反应的能量变化 | 放出a kJ | 吸收79.08 kJ | 放出d kJ |
压强平衡常数(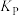 ) ) |  |  | 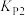 |
①表中:a=
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则
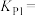

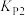 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。③451℃下,若按
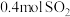 、
、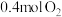 、
、 进行投料,则反应开始时
进行投料,则反应开始时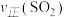
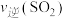 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。(3)将上述固体催化剂
 换成
换成 气体,同样可以起到催化作用,此催化过程如下:
气体,同样可以起到催化作用,此催化过程如下:Ⅱ:
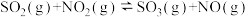
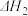
 (浓度平衡常数)
(浓度平衡常数)Ⅲ:

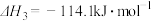
 (浓度平衡常数)
(浓度平衡常数)则
 =
=
 、
、 的表达式表示)。
的表达式表示)。
您最近一年使用:0次



