次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________________ 。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为_________ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为__________ (填化学式)。
③NaH2PO2为___________ (填“正盐”或“酸式盐”)
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:___________________________________ 。
(1)H3PO2是一元中强酸,写出其电离方程式
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为
③NaH2PO2为
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:
更新时间:2016-12-09 08:24:33
|
【知识点】 氧化还原反应方程式的配平解读
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】酸性KMnO4、H2O2在生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要的氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式_______ ,氧化产物与还原产物的物质的量之比为_______ 。
(2)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是_______ mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_______ (用文字表达),又变为棕黄色的离子方程式是_______ 。
(4)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,配平下面方程式_______ 。
_______ +_______
+_______ +_______H+=_______Mn2++_______
+_______H+=_______Mn2++_______ +_______H2O
+_______H2O
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式
(2)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是
(4)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,配平下面方程式
_______
 +_______
+_______ +_______H+=_______Mn2++_______
+_______H+=_______Mn2++_______ +_______H2O
+_______H2O
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】磷单质及其化合物有广泛应用。
(1)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,三聚磷酸钠(俗称“磷酸五钠”)是常用的水处理剂,其化学式为________________ 。
(2)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为_________ 。
②化学镀镍的溶液中含有Ni2+和H2PO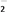 ,在酸性条件下发生下述反应,请配平:
,在酸性条件下发生下述反应,请配平:
____ Ni2++____ H2PO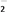 +
+____ ____ Ni++____ H2PO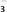 +
+____
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为
2Ca3(PO4)2+6SiO2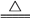 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10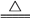 P4+10CO
P4+10CO
若反应生成31 g P4,则反应过程中转移的电子数为___________ (用NA表示阿伏伽德罗常数的值)。
(1)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,三聚磷酸钠(俗称“磷酸五钠”)是常用的水处理剂,其化学式为
(2)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为
②化学镀镍的溶液中含有Ni2+和H2PO
 ,在酸性条件下发生下述反应,请配平:
,在酸性条件下发生下述反应,请配平: +
+ +
+(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为
2Ca3(PO4)2+6SiO2
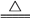 6CaSiO3+P4O10
6CaSiO3+P4O1010C+P4O10
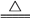 P4+10CO
P4+10CO若反应生成31 g P4,则反应过程中转移的电子数为
您最近一年使用:0次
【推荐3】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO−、 等中回收铜的工艺流程如图:
等中回收铜的工艺流程如图:
(1)步骤(Ⅰ)中被氧化的元素是_____________ ,由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的_____________ (填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,发生的主要反应的离子方程式为_______________________ ,利用Na2S溶液而不选用NaOH溶液“沉铜”的优点是_______________________ 。
(3)步骤(Ⅳ)反应中,氧化剂与还原剂的物质的量之比为_____________ 。
(4)该流程中可以循环利用的物质是__________________________ (填化学式)。
(5)碱式氯化铜在400℃时能完全分解为CuO、H2O和HCl。为测定碱式氯化铜的组成进行如下实验:准确称取42.9g碱式氯化铜,加热到400℃使其完全分解,剩余固体32.0g,将生成的气体通过浓硫酸的洗气瓶,浓硫酸增重3.6g。碱式氯化铜的化学式为__________________________ 。
 等中回收铜的工艺流程如图:
等中回收铜的工艺流程如图: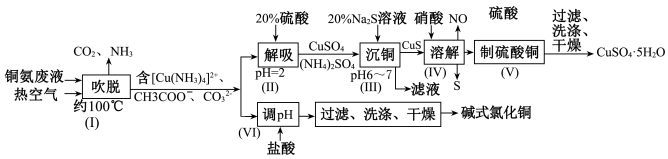
(1)步骤(Ⅰ)中被氧化的元素是
(2)步骤(Ⅲ)“沉铜”时,发生的主要反应的离子方程式为
(3)步骤(Ⅳ)反应中,氧化剂与还原剂的物质的量之比为
(4)该流程中可以循环利用的物质是
(5)碱式氯化铜在400℃时能完全分解为CuO、H2O和HCl。为测定碱式氯化铜的组成进行如下实验:准确称取42.9g碱式氯化铜,加热到400℃使其完全分解,剩余固体32.0g,将生成的气体通过浓硫酸的洗气瓶,浓硫酸增重3.6g。碱式氯化铜的化学式为
您最近一年使用:0次



