利用如图所示装置测定中和热的实验步骤如下:
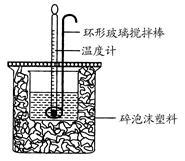
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?___________
(2)倒入NaOH溶液的正确操作是___________ (填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是___________ (填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___________ 。
(5)___________ (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是___________ 。

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?
(2)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
(5)
更新时间:2016-12-09 16:49:37
|
【知识点】 反应热
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】用图中装置测定中和反应热的测定步骤如下:
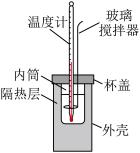
I.测量反应物的温度。
①用量筒量取50mL 盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取50mL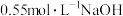 溶液,用温度计测量并记录NaOH溶液的温度。
溶液,用温度计测量并记录NaOH溶液的温度。
Ⅱ.测量反应后体系的温度。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌;密切关注温度变化,将最高温度记为反应后体系的温度 。
。
Ⅲ.重复测定2次,数据记录见下表。
注:稀盐酸和稀碱密度近似为 混合液的比热容为:4.18J/(g·℃)
混合液的比热容为:4.18J/(g·℃)
完成以下问题:
(1)上述操作中将NaOH溶液迅速倒入量热计的内筒,并立即盖上杯盖的目的是___________ 。
(2)测量过程中,测量盐酸后未清洗温度计即用来测量NaOH溶液温度,其他过程无误,测得反应热的绝对值___________ (填“偏大”“不变”或“偏小”,下同);反应后NaOH剩余,测得反应热的数值___________ 。
(3)计算此反应的反应热的数值Q=___________ KJ,写出中和热(生成1mol )的热化学反应方程式
)的热化学反应方程式___________ 。
(4)所有的操作和计算均无误,并忽略散发到量热计外的热量,按照此方法测得中和热的数值仍小于实际值,原因可能是___________ 。

I.测量反应物的温度。
①用量筒量取50mL
 盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。②用另一个量筒量取50mL
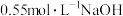 溶液,用温度计测量并记录NaOH溶液的温度。
溶液,用温度计测量并记录NaOH溶液的温度。Ⅱ.测量反应后体系的温度。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌;密切关注温度变化,将最高温度记为反应后体系的温度
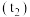 。
。Ⅲ.重复测定2次,数据记录见下表。
| 实验次数 | 反应物温度/℃ | 反应前体系温度 | 反应后体系温度 | 温度差 | |
| 盐酸 | NaOH溶液 |  /℃ /℃ |  /℃ /℃ |  /℃ /℃ | |
| 1 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 2 | 24.8 | 25.0 | 24.9 | 28.1 | 3.2 |
| 3 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
 混合液的比热容为:4.18J/(g·℃)
混合液的比热容为:4.18J/(g·℃)完成以下问题:
(1)上述操作中将NaOH溶液迅速倒入量热计的内筒,并立即盖上杯盖的目的是
(2)测量过程中,测量盐酸后未清洗温度计即用来测量NaOH溶液温度,其他过程无误,测得反应热的绝对值
(3)计算此反应的反应热的数值Q=
 )的热化学反应方程式
)的热化学反应方程式(4)所有的操作和计算均无误,并忽略散发到量热计外的热量,按照此方法测得中和热的数值仍小于实际值,原因可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】乙炔与氯化氢加成制备氯乙烯的反应原理为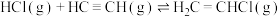 。回答下列问题:
。回答下列问题:
(1)标准状态(298K、101kPa)时,由指定单质生成1mol化合物的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用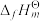 (
( ,g)表示,规定
,g)表示,规定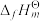 (C,石墨)和
(C,石墨)和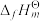 (
( ,g)为0,利用标准摩尔生成焓可以求出化学反应反应热。部分物质的标准摩尔生成焓如表所示。
,g)为0,利用标准摩尔生成焓可以求出化学反应反应热。部分物质的标准摩尔生成焓如表所示。
请计算热化学方程式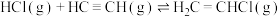 的
的
___________  。在
。在___________ (填“高温”、“低温”或“任何温度”)下有利于该反应自发进行。
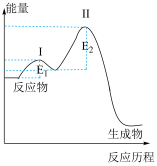
(2)在某催化剂作用下该反应的反应历程如图所示,决速步为___________ (填“Ⅰ”或“Ⅱ”)。
(3)在T℃、初始总压强为1.6MPa下,将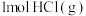 和
和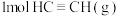 充入2L恒容密闭容器中,反应经过25min后达到平衡状态,此时总压强为1.2MPa.
充入2L恒容密闭容器中,反应经过25min后达到平衡状态,此时总压强为1.2MPa.
①下列条件能作为该反应达到平衡状态标志的是___________ (填标号)。
a.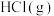 的浓度不再改变
的浓度不再改变
b.单位时间内断裂1molH—Cl键,同时形成1molC—Cl键
c.容器中气体的平均摩尔质量不变
d.容器中混合气体的密度保持不变
②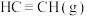 的平衡转化率为
的平衡转化率为___________ %,0~25min内, 为
为___________  。
。
③T℃下该反应的压强平衡常数
___________  。(
。( 为用分压表示的平衡常数,分压=总压×物质的量分数)
为用分压表示的平衡常数,分压=总压×物质的量分数)
(4) 与
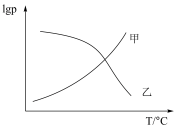
与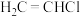 平衡分压的对数
平衡分压的对数 随温度的变化图像如图所示,则表示
随温度的变化图像如图所示,则表示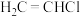 分压的曲线为
分压的曲线为___________ (填“甲”或“乙”)。
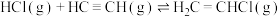 。回答下列问题:
。回答下列问题:(1)标准状态(298K、101kPa)时,由指定单质生成1mol化合物的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用
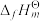 (
( ,g)表示,规定
,g)表示,规定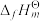 (C,石墨)和
(C,石墨)和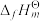 (
( ,g)为0,利用标准摩尔生成焓可以求出化学反应反应热。部分物质的标准摩尔生成焓如表所示。
,g)为0,利用标准摩尔生成焓可以求出化学反应反应热。部分物质的标准摩尔生成焓如表所示。| 物质 | HCl | HC≡CH | 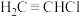 |
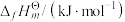 | 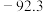 | 226.7 | 35.6 |
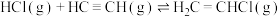 的
的
 。在
。在(2)在某催化剂作用下该反应的反应历程如图所示,决速步为

(3)在T℃、初始总压强为1.6MPa下,将
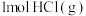 和
和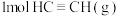 充入2L恒容密闭容器中,反应经过25min后达到平衡状态,此时总压强为1.2MPa.
充入2L恒容密闭容器中,反应经过25min后达到平衡状态,此时总压强为1.2MPa.①下列条件能作为该反应达到平衡状态标志的是
a.
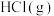 的浓度不再改变
的浓度不再改变b.单位时间内断裂1molH—Cl键,同时形成1molC—Cl键
c.容器中气体的平均摩尔质量不变
d.容器中混合气体的密度保持不变
②
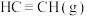 的平衡转化率为
的平衡转化率为 为
为 。
。③T℃下该反应的压强平衡常数

 。(
。( 为用分压表示的平衡常数,分压=总压×物质的量分数)
为用分压表示的平衡常数,分压=总压×物质的量分数)(4)
 与
与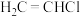 平衡分压的对数
平衡分压的对数 随温度的变化图像如图所示,则表示
随温度的变化图像如图所示,则表示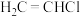 分压的曲线为
分压的曲线为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种但与生产生活有密切的联
系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为_________________ 。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
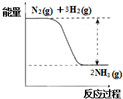
①合成氨的反应中的能量变化如图所示.该反应是__________ 反应 (填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量__________ (填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_____________ (填序号)。
A. 容器中混合气体的密度不随时间变化 B. 断裂3molH-H键的同时断裂6molN-H键
C.N2、H2、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化
(3)碱性电池具有容量大、放电电流大的特点,固而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
则该电池的负极反应是_________ ,放电时,外电路中每通过0.2mol电子,锌的质量理论上减小______ 。
系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)
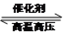 2NH3(g)
2NH3(g) ①合成氨的反应中的能量变化如图所示.该反应是

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是
A. 容器中混合气体的密度不随时间变化 B. 断裂3molH-H键的同时断裂6molN-H键
C.N2、H2、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化
(3)碱性电池具有容量大、放电电流大的特点,固而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
则该电池的负极反应是
您最近一年使用:0次



