为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取25.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。(5SO32-+2MnO4-+6H+→5SO42-+2Mn2++3H2O)
实验中所记录的数据如下表:
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、滴管、药匙和__________________ 、_________________ 。
(2)操作I为____________________ 操作Ⅱ为________________
(3)方案I中如何判别加入的氯化钡已经过量_____________ 在方案Ⅱ中滴定终点的判断方法是________________ 。
(4)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为______________ 。(写成分数形式)有同学模仿方案I,提出方案Ⅲ:取25.00 mL上述溶液→加入足量的盐酸酸化的Ba(NO3)2溶液→操作I→洗涤→操作Ⅱ→称重,得到沉淀质量为m2 g 并用方案I的方法计算结果。
(5)根据方案Ⅲ,从理论上讲,下列说法正确的是________ (填序号)
a. 方案I比方案Ⅲ的计算结果要低
b. 方案I比方案Ⅲ的计算结果要高
c. m1=m2 ,方案I和方案Ⅲ的结果一样
d. 方案Ⅲ不应根据方案I的方法计算
(6)上述实验中,由于操作错误所引起的实验误差分析正确的是__________ (填序号)。
a. 方案I中如果没有洗涤操作,实验结果将偏小
b. 方案I中如果没有操作Ⅱ,实验结果将偏大
c. 方案Ⅲ中如果没有洗涤操作,实验结果将偏小
d. 方案Ⅲ中如果没有操作Ⅱ,实验结果将偏大
方案I:取25.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取25.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。(5SO32-+2MnO4-+6H+→5SO42-+2Mn2++3H2O)
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 25.00 | 25.00 | 25.00 | 25.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(2)操作I为
(3)方案I中如何判别加入的氯化钡已经过量
(4)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为
(5)根据方案Ⅲ,从理论上讲,下列说法正确的是
a. 方案I比方案Ⅲ的计算结果要低
b. 方案I比方案Ⅲ的计算结果要高
c. m1=m2 ,方案I和方案Ⅲ的结果一样
d. 方案Ⅲ不应根据方案I的方法计算
(6)上述实验中,由于操作错误所引起的实验误差分析正确的是
a. 方案I中如果没有洗涤操作,实验结果将偏小
b. 方案I中如果没有操作Ⅱ,实验结果将偏大
c. 方案Ⅲ中如果没有洗涤操作,实验结果将偏小
d. 方案Ⅲ中如果没有操作Ⅱ,实验结果将偏大
17-18高三上·上海·阶段练习 查看更多[2]
更新时间:2017-04-04 16:48:09
|
【知识点】 物质含量的测定
相似题推荐
解答题-实验探究题
|
较难
(0.4)
【推荐1】三草酸合铁酸钾晶体 (M=491g/mol)是一种感光剂和高效的污水处理剂,是制备负载型活性铁催化剂的主要原料,还可以作为一些有机反应的催化剂。
(M=491g/mol)是一种感光剂和高效的污水处理剂,是制备负载型活性铁催化剂的主要原料,还可以作为一些有机反应的催化剂。
I.制备 的途径如下,请回答下列问题:
的途径如下,请回答下列问题:

研究小组通过查阅资料得知:
a. 对光敏感,易溶于水,难溶于乙醇;
对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如 、
、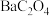 )难溶于水,但能溶解于稀硝酸。
)难溶于水,但能溶解于稀硝酸。
请回答:
(1)步骤③中,控制水浴温度在40℃左右的原因为_______ 。
(2)关于制备流程,下列说法正确的是_______
Ⅱ.测定三草酸合铁酸钾样品(含少量 )的纯度,进行如下实验:
)的纯度,进行如下实验:
步骤1:称取5.000g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤2:取25.00mL溶液,用 酸性
酸性 溶液滴定至终点,消耗12.30mL。
溶液滴定至终点,消耗12.30mL。
步骤3:另取25.00mL溶液,加入过量Zn粉,将 还原成
还原成 ,过滤,洗涤,将滤液和洗涤液合并。
,过滤,洗涤,将滤液和洗涤液合并。
步骤4:用 酸性
酸性 溶液滴定合并后溶液至终点,测得实验数据:
溶液滴定合并后溶液至终点,测得实验数据:
(3)步骤1中所需玻璃仪器除烧杯、玻璃棒、量筒外还有_______ (填仪器名称)。
(4)研究小组制得的 纯度为
纯度为_______ 。
 (M=491g/mol)是一种感光剂和高效的污水处理剂,是制备负载型活性铁催化剂的主要原料,还可以作为一些有机反应的催化剂。
(M=491g/mol)是一种感光剂和高效的污水处理剂,是制备负载型活性铁催化剂的主要原料,还可以作为一些有机反应的催化剂。I.制备
 的途径如下,请回答下列问题:
的途径如下,请回答下列问题:
研究小组通过查阅资料得知:
a.
 对光敏感,易溶于水,难溶于乙醇;
对光敏感,易溶于水,难溶于乙醇;b.很多草酸盐(例如
 、
、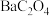 )难溶于水,但能溶解于稀硝酸。
)难溶于水,但能溶解于稀硝酸。请回答:
(1)步骤③中,控制水浴温度在40℃左右的原因为
(2)关于制备流程,下列说法正确的是_______
| A.步骤①为复分解反应,步骤③为氧化还原反应 |
B.步骤②判断 是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 |
C.步骤④,加入乙醇目的在于降低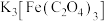 的溶解度,使其结晶析出 的溶解度,使其结晶析出 |
| D.步骤④⑤可以在日光下进行 |
Ⅱ.测定三草酸合铁酸钾样品(含少量
 )的纯度,进行如下实验:
)的纯度,进行如下实验:步骤1:称取5.000g三草酸合铁酸钾晶体,配制成250mL溶液。
步骤2:取25.00mL溶液,用
 酸性
酸性 溶液滴定至终点,消耗12.30mL。
溶液滴定至终点,消耗12.30mL。步骤3:另取25.00mL溶液,加入过量Zn粉,将
 还原成
还原成 ,过滤,洗涤,将滤液和洗涤液合并。
,过滤,洗涤,将滤液和洗涤液合并。步骤4:用
 酸性
酸性 溶液滴定合并后溶液至终点,测得实验数据:
溶液滴定合并后溶液至终点,测得实验数据:实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.10 | 14.90 |
2 | 0.52 | 14.82 |
3 | 0.00 | 16.66 |
4 | 0.30 | 14.10 |
(3)步骤1中所需玻璃仪器除烧杯、玻璃棒、量筒外还有
(4)研究小组制得的
 纯度为
纯度为
您最近半年使用:0次
【推荐2】湿法炼锌综合回收系统产出的萃余液中含有Na2SO4、ZnSO4、H2SO4,还含有Mn2+、Co2+、Ni2+、Cd2+、Fe2+、Al3+等,一种将萃余液中有价离子分步分离、富集回收的工艺流程如下图:
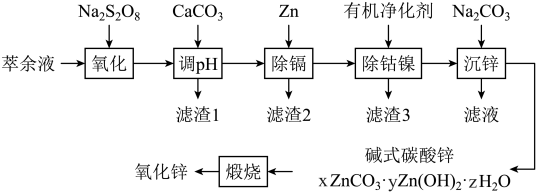
已知:25℃时,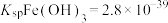 ,
, 。
。
回答下列问题:
(1)“氧化”时,所用氧化剂Na2S2O8阴离子结构为“ ”,则其中硫元素化合价为
”,则其中硫元素化合价为___________ ,其氧化Fe2+的离子方程式为___________ ,其阴离子结构片段“ ”中的所有原子
”中的所有原子___________ (填“是”或“不是”)在一条直线上。
(2)“调pH”时,为了加快反应速率,不宜采取的措施为___________
a.将CaCO3粉碎研细 b.不断搅拌 c.适当降低温度
所得“滤渣I”中除含有MnO2、CaSO4和Al(OH)3,还含有___________ 。
(3)“除钴镍”时,有机净化剂的基本组分为大分子聚合物,其净化原理可表示为
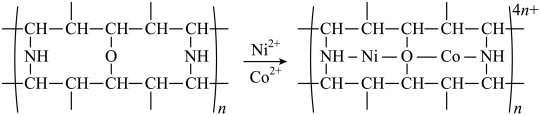
该有机大分子聚合物属于___________ (填“线型”或“网状”)结构。净化反应中,提供孤电子对的原子为___________ (填元素符号)。
(4)“沉锌”时,得到的碱式碳酸锌[xZnCO3·yZn(OH)2·zH2O]摩尔质量为341g/mol。取51.15g碱式碳酸锌固体进行充分煅烧,将产生的气体全部通入到足量Ba(OH)2溶液中,所得沉淀经过滤、洗涤、干燥后称量,其质量为29.55g;碱式碳酸锌煅烧后的固体纯净物质量为36.45g,则x∶y∶z=___________ 。已知“沉锌”时有气体生成,则生成碱式碳酸锌的离子方程式为___________ 。

已知:25℃时,
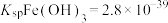 ,
, 。
。回答下列问题:
(1)“氧化”时,所用氧化剂Na2S2O8阴离子结构为“
 ”,则其中硫元素化合价为
”,则其中硫元素化合价为 ”中的所有原子
”中的所有原子(2)“调pH”时,为了加快反应速率,不宜采取的措施为
a.将CaCO3粉碎研细 b.不断搅拌 c.适当降低温度
所得“滤渣I”中除含有MnO2、CaSO4和Al(OH)3,还含有
(3)“除钴镍”时,有机净化剂的基本组分为大分子聚合物,其净化原理可表示为

该有机大分子聚合物属于
(4)“沉锌”时,得到的碱式碳酸锌[xZnCO3·yZn(OH)2·zH2O]摩尔质量为341g/mol。取51.15g碱式碳酸锌固体进行充分煅烧,将产生的气体全部通入到足量Ba(OH)2溶液中,所得沉淀经过滤、洗涤、干燥后称量,其质量为29.55g;碱式碳酸锌煅烧后的固体纯净物质量为36.45g,则x∶y∶z=
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】草酸亚铁不溶于水,可用于制药工业。草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色,可用作照相显影剂。某化学活动小组分别设计了相应装置进行实验。回答下列问题:
I.制备草酸亚铁晶体(装置如图所示):
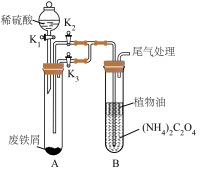
(1)盛放稀硫酸的仪器名称为___________ ;植物油的作用是___________ 。
(2)实验过程中,制备草酸亚铁的具体操作是___________ 。
(3)检验草酸亚铁晶体已洗净的操作方法为___________ 。
II.草酸亚铁晶体热分解产物的探究:
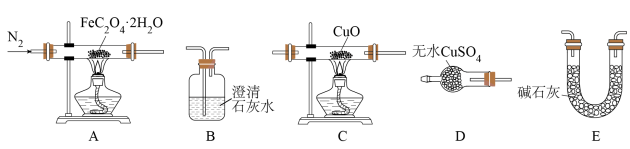
(4)按照气流从左到右的方向,上述装置的连接顺序为___________ →尾气处理装置(填图中字母,装置可重复使用)。
(5)实验结束后,C中黑色固体变为红色,B中澄清石灰水变浑浊,D中无水硫酸铜变为蓝色,A中残留FeO,则A处反应管中发生反应的化学方程式为___________ 。
III.运用热重分析法推测产物:
(6)称取54.0g草酸亚铁晶体(FeC2O4·2H2O)在隔绝空气的条件下加热,得到剩余固体质量随温度变化的曲线如图所示:
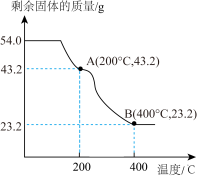
已知B点时,固体只含有一种铁的氧化物,根据上图可知B点固体物质的化学式为_______ 。
I.制备草酸亚铁晶体(装置如图所示):

(1)盛放稀硫酸的仪器名称为
(2)实验过程中,制备草酸亚铁的具体操作是
(3)检验草酸亚铁晶体已洗净的操作方法为
II.草酸亚铁晶体热分解产物的探究:

(4)按照气流从左到右的方向,上述装置的连接顺序为
(5)实验结束后,C中黑色固体变为红色,B中澄清石灰水变浑浊,D中无水硫酸铜变为蓝色,A中残留FeO,则A处反应管中发生反应的化学方程式为
III.运用热重分析法推测产物:
(6)称取54.0g草酸亚铁晶体(FeC2O4·2H2O)在隔绝空气的条件下加热,得到剩余固体质量随温度变化的曲线如图所示:

已知B点时,固体只含有一种铁的氧化物,根据上图可知B点固体物质的化学式为
您最近半年使用:0次



