短周期主族元素 A、B、C、D、E、F 的原子序数依次增大,A 原子核外最外 层电子数是其电子层数的 2 倍,A、B 的核电荷数之比为 3:4。C 与 D 均为金属元素,5.8 g D 的氢氧化物恰好能与 100 mL 2 mol·L-1 盐酸完全反应,D 原子核中质子数和中子数相等。E 与F 相邻,F-的最外层为 8 电子结构。根据上述条件,用化.学.用.语.回答:
(1)D 在周期表中的位置____ ;
(2)B、C 易形成淡黄色化合物,其电子式为____ ,该物质含有的化学键 类型为_____ ;
(3)用电子式表示 DF2 的形成过程____ ;
(4)元素 E、F 中非金属性较强的是____ ,请用一个置换反应证明____ (写化学反应方程式);
(5)原子半径:C____ E;熔点:DB____ CF(填“>”“<”或“=”);
(6)A、B、E 可形成一个三原子分子,且每个原子均达到 8 电子稳定结构,则该分子的 结构式为____ ;含 A元素的化合物在是自然界种类最多的原因是____ 。
(1)D 在周期表中的位置
(2)B、C 易形成淡黄色化合物,其电子式为
(3)用电子式表示 DF2 的形成过程
(4)元素 E、F 中非金属性较强的是
(5)原子半径:C
(6)A、B、E 可形成一个三原子分子,且每个原子均达到 8 电子稳定结构,则该分子的 结构式为
更新时间:2017-04-23 17:21:59
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】(1)已知CuCl2溶液与乙二胺H2N-CH2CH2-NH2[常用(en)表示]作用,可形成配离子(如图所示):
请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是____________ ,
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是___________________________ 。
②上述配离子中含有的化学键类型有:__________________ 。(填写代码,多选) ;
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为_______ ;其中铜离子的配位数是_______ 。
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为__________________
②Fe元素位于周期表的_____ 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为____ ;
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为______ 和______ (填化学式)。
③根据VSEPR理论预测ED4-离子的空间构型为_________ 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的化学式为____________ (写2种)。

请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是
②上述配离子中含有的化学键类型有:
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为
②Fe元素位于周期表的
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为
③根据VSEPR理论预测ED4-离子的空间构型为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】硫化锌荧光材料的研究从1868年法国化学家Sidot发现至今已有近150年的历史。其中立方硫化锌的晶胞如图所示。请回答下列问题:
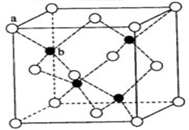
(1)锌元素在周期表中的位于第______ 周期_____ 族, 属于_____ 区;
(2)基态锌原子的价电子排布式为_________ ;
(3)一般锌元素常表现为+2 价的原因是_____ ;
(4)立方硫化锌晶体的每个晶胞中含有_____ 个锌离子, 其配位数为_____ ;含有_____ 个硫离子,其配位数为_____ ;
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________ g·cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为_____ pm(列式表示)。

(1)锌元素在周期表中的位于第
(2)基态锌原子的价电子排布式为
(3)一般锌元素常表现为+2 价的原因是
(4)立方硫化锌晶体的每个晶胞中含有
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】短周期元素 a~g 在表中的位置如右表,请回答下列问题:
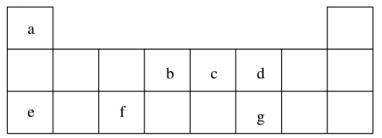
(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)__________ ;b、c两元素非金属性较强的是(写元素符号)_________ ,写出能证明这一结论的一个化学方程式_____________ 。
(2)下列有关说法正确的是( )
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+)_______ (填“=”、 “>”或“<”)0.1 mol·L-1盐S中c(ca4+)。
②R常用作净水剂,其原理为(用离子方程式表示)______________ 。
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是_____________ 。
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:_____________ 。

(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)
(2)下列有关说法正确的是
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+)
②R常用作净水剂,其原理为(用离子方程式表示)
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族族序数相等,请回答下列问题

(1)Q元素在元素周期表中的位置为________ 。
(2)T元素的离子结构示意图为_____________ 。
(3)元素的非金属性(原子的得电子能力):Q_______ R(填“强于”或“弱于”),可作为二者非金属强弱的判断依据是________________________________________________ 。
(4)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该气体能使品红溶液褪色,该反应的化学方程式为____________________ 。

(1)Q元素在元素周期表中的位置为
(2)T元素的离子结构示意图为
(3)元素的非金属性(原子的得电子能力):Q
(4)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该气体能使品红溶液褪色,该反应的化学方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】I如表所示为元素周期表的一部分,参照元素①~⑩在表中的位置,请回答下列问题:
(1)写出①和④两种元素原子按1:1组成的常见化合物的电子式________ 。
(2)用电子式表示⑥和⑨形成化合物的过程:________ 。
(3)③、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为________ (用化学式表示)。
(4)已知周期表中存在对角相似规则,如②与⑦在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑥的氢氧化物反应的化学方程式________ 。
(5)⑤、⑥、⑩的离子半径由大到小的顺序为(用离子符号表示)________ 。
Ⅱ某同学欲利用下图装置验证同主族元素性质递变规律。若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为________ ,反应离子方程式为________ ,即可证明。
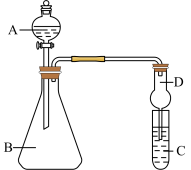
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)写出①和④两种元素原子按1:1组成的常见化合物的电子式
(2)用电子式表示⑥和⑨形成化合物的过程:
(3)③、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为
(4)已知周期表中存在对角相似规则,如②与⑦在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑥的氢氧化物反应的化学方程式
(5)⑤、⑥、⑩的离子半径由大到小的顺序为(用离子符号表示)
Ⅱ某同学欲利用下图装置验证同主族元素性质递变规律。若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】安全气囊是行车安全的重要设施。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客。为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究。经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、O四种元素。
(1)氧元素在元素周期表中的位置是__________________ ,Na原子结构示意图为_____________ ,其中三种主族元素的离子半径从大到小的顺序是___________________ (用离子符号表示)。
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐晶体中含有的化学键类 型是
型是____________________ 。
(3)水溶性实验表明,安全气囊中固体粉末部分溶解,不溶物为一种红棕色固体,可溶于盐酸,写出反应的化学方程式_______________________________________________ 。
(1)氧元素在元素周期表中的位置是
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐晶体中含有的化学键类
 型是
型是(3)水溶性实验表明,安全气囊中固体粉末部分溶解,不溶物为一种红棕色固体,可溶于盐酸,写出反应的化学方程式
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】按要求填空:
(1)原子核外有3个电子层,其价电子数为7的元素其最高价氧化物对应水化物化学式________ ,其单质与NaOH反应的化学方程式为____________________________________________________ 。
(2)已知X+、Y2+、Zˉ、W2ˉ四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是___________________ ,原子半径由大到小的顺序是__________________ 。
(3) A+、Bˉ、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++Bˉ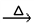 C+D↑,则A+、Bˉ的电子式:
C+D↑,则A+、Bˉ的电子式:_____________ ,______________ ;比较C和D的稳定性的强弱:_____________________ (用化学式表示)。
(4)①NH4NO3 ②NaF ③CO2 ④K2O2 ⑤NaOH ⑥CH4
以上只含有极性键的是_______ (填序号),既有离子键又有非极性键的是______ (填序号);既有离子键又有极性键的是______ (填序号)。
(5)下列原子: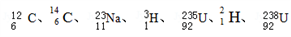 中共有
中共有____ 种元素,__ 种核素。
(6)写出下列物质或微粒的电子式:
①CO2__________ ②KCl_____________ ③H2O2_______________ ④N2_____________ ;
⑤用电子式表示MgCl2的形成过程_________________________________________________ 。
(1)原子核外有3个电子层,其价电子数为7的元素其最高价氧化物对应水化物化学式
(2)已知X+、Y2+、Zˉ、W2ˉ四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是
(3) A+、Bˉ、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++Bˉ
 C+D↑,则A+、Bˉ的电子式:
C+D↑,则A+、Bˉ的电子式:(4)①NH4NO3 ②NaF ③CO2 ④K2O2 ⑤NaOH ⑥CH4
以上只含有极性键的是
(5)下列原子:
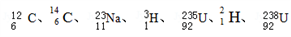 中共有
中共有(6)写出下列物质或微粒的电子式:
①CO2
⑤用电子式表示MgCl2的形成过程
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】硫代硫酸钠(Na2S2O3)是一种常用的化工原料,常用作除氯剂等。回答下列问题:
(1)硫代硫酸钠中所含的化学键类型为_______________________ 。
(2)硫代硫酸钠在中性或碱性溶液中稳定,在酸性溶液中不稳定。向pH=2的硫酸中滴加Na2S2O3溶液,可观察到的现象是________________ 。
(3)实验测定Na2S2O3溶液呈弱碱性,用离子方程式解释其主要原因:__________ ,25℃时该离子反应的平衡常数值约为__________________
【已知:25℃时K1(H2S2O3)=2.52×10-1mol/L,K2(H2S2O3)=1.02xl0-2mol/L】
(4)实际生产中,一般将Na2S和Na2CO3以物质的量比2∶1配成溶液后加热,将SO2缓缓通入溶液中,即可得到硫代硫酸钠。反应的化学方程式为_______________________ 。
(5)在水产养殖上,硫代硫酸钠常用于除去自来水中的氯气,理论上,去除1g的氯需要0.56g硫代硫酸钠。硫代硫酸钠作除氯剂的主要原因是其具有_________ 性,反应的离子方程式为___________________ 。
(1)硫代硫酸钠中所含的化学键类型为
(2)硫代硫酸钠在中性或碱性溶液中稳定,在酸性溶液中不稳定。向pH=2的硫酸中滴加Na2S2O3溶液,可观察到的现象是
(3)实验测定Na2S2O3溶液呈弱碱性,用离子方程式解释其主要原因:
【已知:25℃时K1(H2S2O3)=2.52×10-1mol/L,K2(H2S2O3)=1.02xl0-2mol/L】
(4)实际生产中,一般将Na2S和Na2CO3以物质的量比2∶1配成溶液后加热,将SO2缓缓通入溶液中,即可得到硫代硫酸钠。反应的化学方程式为
(5)在水产养殖上,硫代硫酸钠常用于除去自来水中的氯气,理论上,去除1g的氯需要0.56g硫代硫酸钠。硫代硫酸钠作除氯剂的主要原因是其具有
您最近一年使用:0次








