如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.试回答下列问题:

(1)元素o为25号元素,请写出其基态原子的电子排布式______ .
(2)d与a反应的产物的分子中,中心原子的杂化形式为______ .
(3)d、e、f三种元素的电负性大小顺序为(用元素符号表示)_________________ .
(4)o、p两元素的部分电离能数据列于下表:
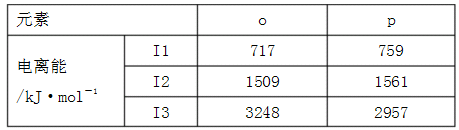
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是______ .

(1)元素o为25号元素,请写出其基态原子的电子排布式
(2)d与a反应的产物的分子中,中心原子的杂化形式为
(3)d、e、f三种元素的电负性大小顺序为(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:

比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是
更新时间:2017-05-02 16:27:10
|
【知识点】 物质结构与性质综合考查解读
相似题推荐
填空题
|
适中
(0.65)
【推荐1】第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)Cr的核外电子排布式为_________________________ ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:

图中虚线表示的作用力为____________________ ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是_______ ,其中心原子的杂化轨道类型是______ ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是________ , Ni(CO)4易溶于下列_____________ 。
(1)Cr的核外电子排布式为
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:

图中虚线表示的作用力为
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
您最近半年使用:0次
【推荐2】不锈钢是由铁、铬(Cr)、镍(Ni)、碳、硅及众多不同元素组成的合金。完成下列填空:
(1)写出碳原子最外层电子的轨道表示式______________ ,其最外层有____ 种不同运动状态的电子。
(2)硅烷(SiH4)可用于制备高纯硅,已知硅烷的分解温度远低于甲烷,从原子结构角度解释其原因:_____________________________________________________ 。
(3)下面是工业上冶炼Cr时涉及到的反应:
CrO42-+ S+ H2O→ Cr(OH)3↓+ S2O32-+
①请将方程式补充完整并配平____________________ 。
②上述反应中,若转移了3mol电子,得到的还原产物是__________ mol。
③Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的电离方程式________ 。
(4)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。Ni(CO)4是________________ 晶体,Ni(CO)4易溶于下列_______ (填序号)。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
(1)写出碳原子最外层电子的轨道表示式
(2)硅烷(SiH4)可用于制备高纯硅,已知硅烷的分解温度远低于甲烷,从原子结构角度解释其原因:
(3)下面是工业上冶炼Cr时涉及到的反应:
CrO42-+ S+ H2O→ Cr(OH)3↓+ S2O32-+
①请将方程式补充完整并配平
②上述反应中,若转移了3mol电子,得到的还原产物是
③Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的电离方程式
(4)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。Ni(CO)4是
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】物质的组成与结构决定了物质的性质与变化。请回答下列问题:
(1)C、H、N、O四种元素中电负性最大的是____ (填元素符号),写出Fe2+的最外层电子排布式____ 。
(2)根据等电子原理,写出CN-的电子式___ ,CNO-中心原子的杂化方式为 ________ 。
(3)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点由高到低顺序是___ (用化学式表示),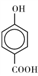 的沸点比
的沸点比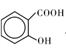
____ (填“高”或“低”);原因是______________________ .
(4)铁有δ、γ、α三种同素异形体,如下图所示。
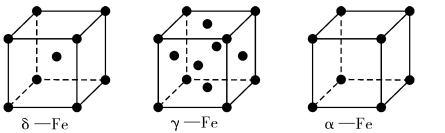
γ -Fe晶体的一个晶胞中所含有的铁原子数为____ ,δ一Fe、α- Fe两种晶胞中铁原子的配位数之比为____ 。已知δ-Fe晶体的密度为dg/cm3,NA表示阿伏伽德罗常数的数值,则Fe原子半径为____ pm(列表达式)。
(1)C、H、N、O四种元素中电负性最大的是
(2)根据等电子原理,写出CN-的电子式
(3)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点由高到低顺序是
 的沸点比
的沸点比
(4)铁有δ、γ、α三种同素异形体,如下图所示。

γ -Fe晶体的一个晶胞中所含有的铁原子数为
您最近半年使用:0次



