第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)Cr的核外电子排布式为_________________________ ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:

图中虚线表示的作用力为____________________ ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是_______ ,其中心原子的杂化轨道类型是______ ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是________ , Ni(CO)4易溶于下列_____________ 。
(1)Cr的核外电子排布式为
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:

图中虚线表示的作用力为
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
2010·山东青岛·二模 查看更多[1]
(已下线)2010年山东青岛市高三第二次模拟练习
更新时间:2010-05-09 20:17:33
|
相似题推荐
填空题
|
适中
(0.65)
名校
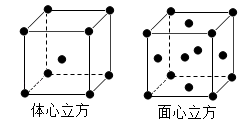
【推荐1】(1)金属铁的晶体在不同温度下有两种堆积方式,晶胞如图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为_____ 。
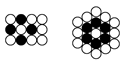
(2)等径圆球在二维空间里进行排列,可形成密置层和非密置层,在下图所示的半径相等的圆球的排列中,A属于_____ 层,配位数是_____ ,将其在三维空间中按照圆球正对圆球的方式堆积,得到_____ 堆积,其空间利用率最小,为_____ (结果取三位有效数字)。
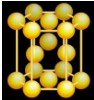
(3)将B层一层一层地在三维空间里堆积,可以得到六方最密堆积,晶体如图.在这种晶体中金属原子的配位数是_____ ,平均每个晶胞所占有的原子数目是_____ 。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为____________ 。列式表示Al单质的密度___________________ g·cm-3(不必计算出结果)。

(2)等径圆球在二维空间里进行排列,可形成密置层和非密置层,在下图所示的半径相等的圆球的排列中,A属于

(3)将B层一层一层地在三维空间里堆积,可以得到六方最密堆积,晶体如图.在这种晶体中金属原子的配位数是

(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】 下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列问题:
(1)以上元素的基态原子的电子排布中,4s轨道上只有1个电子的元素有______ (填元素名称)。
(2)以上元素中,属于s区的元素有_____ 种,属于d区的元素有______ 种。
(3)第一电离能I1(Cr)________ I1(Co)(填“>”、“<”或“=”,下同)。
(4)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的 。试推断紫色晶体的化学式为
。试推断紫色晶体的化学式为_________ 。
(5)含有元素K的盐的焰色反应为__________ 色。许多金属盐都可以发生焰色反应,其原因是____________ 。
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)以上元素的基态原子的电子排布中,4s轨道上只有1个电子的元素有
(2)以上元素中,属于s区的元素有
(3)第一电离能I1(Cr)
(4)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
 。试推断紫色晶体的化学式为
。试推断紫色晶体的化学式为(5)含有元素K的盐的焰色反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E、F用所对应的元素符号表示)
(1)F基态原子核外价电子排布式是________________
(2)A、B、E三种元素电负性由大到小排列顺序为__________________
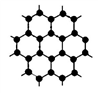
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为________________
(4)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
2BO2(g) B2O4(g) △H2=-56.9 kJ/mol
B2O4(g) △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式__________________
(5)D单质为面心立方晶体,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,列式表示D单质的密度______ g·cm-3(不必计算出结果)。
(6)继A60后,科学家又合成了E60、B60, E60分子中每个E原子只跟相邻的3个原子形成共价键,且每个E原子最外层都满足8电子稳定结构,则E60分子中π键的数目为_______________
(7)F的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出该原电池正极反应方程式_______________
(8)某学生所做的有关F元素的实验流程如下图:
F单质 棕色的烟
棕色的烟 绿色溶液
绿色溶液 蓝色沉淀
蓝色沉淀 蓝色溶液
蓝色溶液 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:___________________
A | A原子核外电子有6种不同的运动状态 |
B | B元素的第一电离能比同周期相邻两个元素都大 |
C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
D | D原子最外层电子数等于电子层数 |
E | E的基态原子最外层电子排布式为3s23p2 |
F | F与C位于不同周期,F原子核外最外层电子数与C相同,其余各层电子均充满 |
(1)F基态原子核外价电子排布式是
(2)A、B、E三种元素电负性由大到小排列顺序为
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为
(4)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
2BO2(g)
 B2O4(g) △H2=-56.9 kJ/mol
B2O4(g) △H2=-56.9 kJ/mol写出AH4和B2O4反应的热化学方程式
(5)D单质为面心立方晶体,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,列式表示D单质的密度
(6)继A60后,科学家又合成了E60、B60, E60分子中每个E原子只跟相邻的3个原子形成共价键,且每个E原子最外层都满足8电子稳定结构,则E60分子中π键的数目为
(7)F的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出该原电池正极反应方程式
(8)某学生所做的有关F元素的实验流程如下图:
F单质
 棕色的烟
棕色的烟 绿色溶液
绿色溶液 蓝色沉淀
蓝色沉淀 蓝色溶液
蓝色溶液 黑色沉淀
黑色沉淀请书写第⑤步反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】(1)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是__________________ ,
② 六氰合亚铁离子[Fe(CN)6]4−中的配位体CN−中具有的共价键类型是_______ 键(填“σ”、“π”或“σ”和“π”)。
(2)配位化学创始人维尔纳发现,将各为lmol的CoCl3 • 6NH3(黄色)、CoCl3• 5NH3、(紫红色)、CoCl3 • 4NH3(绿色)、CoCl3 • 4NH3(紫色)四种配合物溶于水,加入足量硝酸银溶液,立即沉淀的氯化银分别为3mol、2mol、lmol和lmol。已知上述配合物中配离子的配位数均为6。
① 请根据实验事实用配合物的形式写出它们的化学式。CoCl3• 6NH3_______ ,CoCl3• 5NH3_______ ,CoCl3 • 4NH3(绿色和紫色)_______ 。
② 后两种物质组成相同而颜色不同的原因是它们互为同分异构体,已知绿色的配合物界内结构对称,请在下图中用元素符号标出氯原子的位置__________ 。

① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
② 六氰合亚铁离子[Fe(CN)6]4−中的配位体CN−中具有的共价键类型是
(2)配位化学创始人维尔纳发现,将各为lmol的CoCl3 • 6NH3(黄色)、CoCl3• 5NH3、(紫红色)、CoCl3 • 4NH3(绿色)、CoCl3 • 4NH3(紫色)四种配合物溶于水,加入足量硝酸银溶液,立即沉淀的氯化银分别为3mol、2mol、lmol和lmol。已知上述配合物中配离子的配位数均为6。
① 请根据实验事实用配合物的形式写出它们的化学式。CoCl3• 6NH3
② 后两种物质组成相同而颜色不同的原因是它们互为同分异构体,已知绿色的配合物界内结构对称,请在下图中用元素符号标出氯原子的位置

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】碳、氮元素及其化合物与生产、生活密切相关,回答下列问题。
(1)K3[Fe(CN)6]中Fe3+与CN-之间的作用为___ ,该化学键能够形成的原因是___ 。
(2)某有机物的结构简式为 。该有机物分子中采取sp3杂化的原子对应元素的电负性由大到小的顺序为
。该有机物分子中采取sp3杂化的原子对应元素的电负性由大到小的顺序为___ 。
(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为___ 。
(4)NH4Cl中阳离子中心原子的价层电子对数为___ ,该物质中不含有___ 。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.σ键 F.π键
(5)NCl3的立体构型为___ ,其中心原子的杂化轨道类型为___ 。
(1)K3[Fe(CN)6]中Fe3+与CN-之间的作用为
(2)某有机物的结构简式为
 。该有机物分子中采取sp3杂化的原子对应元素的电负性由大到小的顺序为
。该有机物分子中采取sp3杂化的原子对应元素的电负性由大到小的顺序为(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为
(4)NH4Cl中阳离子中心原子的价层电子对数为
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.σ键 F.π键
(5)NCl3的立体构型为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】铜是生命必要的元素,也是人类最早使用的金属之一,西汉时期《淮南万毕术》里就有“曾青得铁,则化为铜”的记载,曾青可能是碳酸铜一类物质,把其溶于酸中得溶液,当把铁粉投入此溶液即可得铜。
(1)根据学过的化学知识,写出该过程的离子方程式:________ 。
(2)在化学反应中,铜元素可表现为0、+1、+2。Cu2+ 的未成对电子数有______ 个,向硫酸铜溶液中加入过量的氨水可以得到 [Cu(NH3)4]SO4 溶液,[Cu(NH3)4]2+的结构简式为___ 。
(3)向[Cu(NH3)4]SO4 水溶液中通入SO2 气体至溶液呈微酸性,析出白色沉淀CuNH4SO3。反应化学方程式为_____________ 。
(4)CuNH4SO3 与足量的硫酸混合并微热,得到金属Cu等物质,本法制得的Cu呈超细粉末状,有重要用途,写出该反应的离子方程式________ ,若该反应在密闭容器中进行,且酸量充足,计算反应物中Cu元素变成超细粉末Cu的转化率_______ ,理由是__________ 。
(1)根据学过的化学知识,写出该过程的离子方程式:
(2)在化学反应中,铜元素可表现为0、+1、+2。Cu2+ 的未成对电子数有
(3)向[Cu(NH3)4]SO4 水溶液中通入SO2 气体至溶液呈微酸性,析出白色沉淀CuNH4SO3。反应化学方程式为
(4)CuNH4SO3 与足量的硫酸混合并微热,得到金属Cu等物质,本法制得的Cu呈超细粉末状,有重要用途,写出该反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。
(1)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该离子的离子符号是________ 。
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为_________ 。
(2)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于________ (填字母代号)。
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
(3)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,表示该反应的离子方程式为:___________ ;能使该反应发生的可能原因是________ 。
(1)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该离子的离子符号是
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为
(2)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
(3)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,表示该反应的离子方程式为:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛,则基态Ge原子的核外电子排布式为[Ar]____________ ,有__________ 个未成对电子。
(2)碳及其化合物广泛存在于自然界中,则处于一定空间运动状态的电子在原子核外出现的概率密度分布可用__________ 形象化描述。在基态原子中,核外存在_______ 对自旋相反的电子。
(3)基态铁原子有______ 个未成对电子,三价铁离子的电子排布式为:____________ ,可用硫氰化钾检验三价铁离子,形成配合物的颜色为____________
(4)基态Si原子中,电子占据的最高能层符号_____ ,该能层具有的原子轨道数为_____ 、电子数为________ 。
(2)碳及其化合物广泛存在于自然界中,则处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(3)基态铁原子有
(4)基态Si原子中,电子占据的最高能层符号
您最近一年使用:0次
【推荐1】回答下列问题:
(1) 中含有的含氧官能团名称是
中含有的含氧官能团名称是___________ 。碳原子的杂化方式有___________ ;分子式是___________ ;有___________ 个手性碳原子。
(2)已知熔融的BeCl2不导电,则BeCl2属于___________ 晶体,中心原子的杂化类型为___________ 。
(3)氨水是一种速效氮肥:
①氨水中存在___________ 种氢键,氨极易溶于水的原因是___________ ;
②氨水中含有配位键的粒子有H3O+和X,则X离子中形成的配位键中提供孤电子对的原子是___________ ,X离子能否作为其他配合物的配位体___________ (填“能”或“否”)。
(1)
 中含有的含氧官能团名称是
中含有的含氧官能团名称是(2)已知熔融的BeCl2不导电,则BeCl2属于
(3)氨水是一种速效氮肥:
①氨水中存在
②氨水中含有配位键的粒子有H3O+和X,则X离子中形成的配位键中提供孤电子对的原子是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是_______(填字母)。
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有_______ 种。
(3)Na与N形成的NaN3可用于汽车的安全气囊中,其中阴离子的空间结构为_______ ,Na在空气中燃烧发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为_______ (填“发射”或“吸收”)光谱。
(4)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供_______ ,在BH3·NH3中B原子的杂化方式为_______ 。
(1)下列N原子的电子排布图表示的状态中,能量最高的是_______(填字母)。
A. | B. |
C. | D. |
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有
(3)Na与N形成的NaN3可用于汽车的安全气囊中,其中阴离子的空间结构为
(4)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供
您最近一年使用:0次


 、
、 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式)。
(列出计算式)。



