铜及其化合物具有广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子的基态核外电子排布式为__________ ,S、O、N三种元素的第一电离能由大到小的顺序为___________________ 。
(2)Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NH3中心原子的杂化轨道类型为________ ,[Cu(NH3)4](NO3)2中存在的化学键除了极性共价键外,还有___________ 。
(3)CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN‑中含有的π键数目为_____________ 。与CN-互为等电子体的离子有_________ (写出一种即可)。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因可能是_______________________________ 。
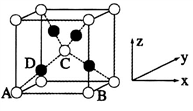
(5)已知Cu2O晶胞结构如图所示:该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);c为 。则D原子的坐标参数为
。则D原子的坐标参数为__________ ,它代表_________ 原子(填元素符号)。
(6)金属铜是面心立方最密堆积方式,则晶体中铜原子的配位数是_______ ,该晶胞中Cu原子的空间利用率是__________ 。
(1)CuSO4和Cu(NO3)2中阳离子的基态核外电子排布式为
(2)Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NH3中心原子的杂化轨道类型为
(3)CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN‑中含有的π键数目为
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因可能是

(5)已知Cu2O晶胞结构如图所示:该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);c为
 。则D原子的坐标参数为
。则D原子的坐标参数为(6)金属铜是面心立方最密堆积方式,则晶体中铜原子的配位数是
更新时间:2017-04-28 10:47:10
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】在工农业生产中锌,铜等金属有着广泛的应用。
(1) 基态核外电子能级共
基态核外电子能级共___________ 个。
(2)C、N、O三种元素的第一电离能由小到大的顺序为___________ 。
(3)ZSM是2-甲基咪唑和水杨酸与锌形成的化合物,2-甲基咪唑可通过下列反应制备:

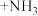 。2-甲基咪唑中碳原子杂化轨道类型为
。2-甲基咪唑中碳原子杂化轨道类型为___________ ;1mol 2-甲基咪唑分子中含 键数目为
键数目为___________ ;NH3的空间构型___________ ; 易溶于水的主要原因是
易溶于水的主要原因是___________ ;
(4)C919制造过程中采用碳化钨做发动机的材料。下图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙化合物。在此结构中,钨原子二维堆积方式为___________ ,1个钨原子周围距离钨原子最近的碳原子有___________ 个,下列金属原子的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是___________ 。
A.Cu Ag Au B.Zn Ti Mg C.Na K Fe D.Po

(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________ g·cm-3.(只需写出表达式,不需要计算)
(1)
 基态核外电子能级共
基态核外电子能级共(2)C、N、O三种元素的第一电离能由小到大的顺序为
(3)ZSM是2-甲基咪唑和水杨酸与锌形成的化合物,2-甲基咪唑可通过下列反应制备:


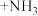 。2-甲基咪唑中碳原子杂化轨道类型为
。2-甲基咪唑中碳原子杂化轨道类型为 键数目为
键数目为 易溶于水的主要原因是
易溶于水的主要原因是(4)C919制造过程中采用碳化钨做发动机的材料。下图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙化合物。在此结构中,钨原子二维堆积方式为
A.Cu Ag Au B.Zn Ti Mg C.Na K Fe D.Po

(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】研究过渡元素的结构与性质具有重要意义。回答下列问题:
(1)已知 的原子序数是42,基态
的原子序数是42,基态 原子的价电子排布式为
原子的价电子排布式为___________ , 在元素周期表中的位置为
在元素周期表中的位置为___________ 。
(2)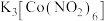 可用于配制黄色颜料,
可用于配制黄色颜料, 的配位数是
的配位数是___________ ,其配体的空间结构为___________ 。
(3) 能与丁二酮肟生成鲜红色的丁二酮肟镍(结构如图所示)沉淀,可用于检验
能与丁二酮肟生成鲜红色的丁二酮肟镍(结构如图所示)沉淀,可用于检验 。
。___________ 。
②丁二酮肟镍中含有的化学键类型有___________ (填字母)。
A.离子键 B.配位键 C.氢键 D.共价键
(4)一种由 和
和 组成的储氢材料的结构属立方晶系,晶胞参数为
组成的储氢材料的结构属立方晶系,晶胞参数为 ,晶胞如图所示(氢未标出)。
,晶胞如图所示(氢未标出)。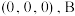 点原子的分数坐标为
点原子的分数坐标为 ,则C点原子的分数坐标为
,则C点原子的分数坐标为___________ 。
②该结构中,H原子以正八面体的配位模式有序分布在 的周围,H原子与
的周围,H原子与 原子之间的最短距离等于晶胞参数的
原子之间的最短距离等于晶胞参数的 ,则该晶体的化学式为
,则该晶体的化学式为___________ ,晶胞密度为___________  (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
(1)已知
 的原子序数是42,基态
的原子序数是42,基态 原子的价电子排布式为
原子的价电子排布式为 在元素周期表中的位置为
在元素周期表中的位置为(2)
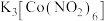 可用于配制黄色颜料,
可用于配制黄色颜料, 的配位数是
的配位数是(3)
 能与丁二酮肟生成鲜红色的丁二酮肟镍(结构如图所示)沉淀,可用于检验
能与丁二酮肟生成鲜红色的丁二酮肟镍(结构如图所示)沉淀,可用于检验 。
。
②丁二酮肟镍中含有的化学键类型有
A.离子键 B.配位键 C.氢键 D.共价键
(4)一种由
 和
和 组成的储氢材料的结构属立方晶系,晶胞参数为
组成的储氢材料的结构属立方晶系,晶胞参数为 ,晶胞如图所示(氢未标出)。
,晶胞如图所示(氢未标出)。
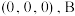 点原子的分数坐标为
点原子的分数坐标为 ,则C点原子的分数坐标为
,则C点原子的分数坐标为②该结构中,H原子以正八面体的配位模式有序分布在
 的周围,H原子与
的周围,H原子与 原子之间的最短距离等于晶胞参数的
原子之间的最短距离等于晶胞参数的 ,则该晶体的化学式为
,则该晶体的化学式为 (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】过渡元素因其独特的化学性质和物理特性,在现代工农业生产和科技发展方面发挥着重要作用。不仅在金属材料、合金材料、磁性材料、催化剂、医疗器材等多个传统领城有着广泛的用途,还在新材料的开发、能源的生产利用等方而展现出新的潜力。
(1)Fe元素在元素周期表中的位置为__________ ,Fe元素的原子结构示意图为__________ 。基态 的核外电子排布式为
的核外电子排布式为__________ 。
(2)基态Cr原子价层电子的轨道表示式为__________ 。
(3)基态Zn原子中有__________ 种不同能量的电子。
(4)配位化学创始人维尔纳发现,取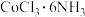 (黄色)、
(黄色)、 (紫红色)、
(紫红色)、 (绿色)和
(绿色)和 (紫色)四种化合物各1mol分别溶于水,加入足量硝酸银溶液,生成AgCl的物质的量分别为3mol、2mol、1mol和1mol。请根据实验事实用配合物的形式写出
(紫色)四种化合物各1mol分别溶于水,加入足量硝酸银溶液,生成AgCl的物质的量分别为3mol、2mol、1mol和1mol。请根据实验事实用配合物的形式写出 的化学式:
的化学式:__________ 。
(1)Fe元素在元素周期表中的位置为
 的核外电子排布式为
的核外电子排布式为(2)基态Cr原子价层电子的轨道表示式为
(3)基态Zn原子中有
(4)配位化学创始人维尔纳发现,取
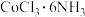 (黄色)、
(黄色)、 (紫红色)、
(紫红色)、 (绿色)和
(绿色)和 (紫色)四种化合物各1mol分别溶于水,加入足量硝酸银溶液,生成AgCl的物质的量分别为3mol、2mol、1mol和1mol。请根据实验事实用配合物的形式写出
(紫色)四种化合物各1mol分别溶于水,加入足量硝酸银溶液,生成AgCl的物质的量分别为3mol、2mol、1mol和1mol。请根据实验事实用配合物的形式写出 的化学式:
的化学式:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态Mn原子的价电子排布式为___________ 。
(2)现代化学中,常利用_______________________ 上的特征谱线来鉴定元素。
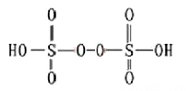
(3)已知H2S2O8的结构如图。H2S2O8硫原子的轨道杂化方式为__________ ;上述反应每生成1molMnO4-,S2O82- 断裂的共价键类型及其数目为_____________________ ;与硫酸根等电子体的分子或离子有______________________ (写两种)。
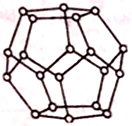
(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。如图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为___________ ;实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是_________________ 。
(5)与Mn同周期相邻的元素X,价电子层有2对成对电子,其离子型氧化物晶胞如图所示。它由A、B方块组成。则该氧化物中X2+、X3+、O2-的个数比为_____________ (填最简整数比);已知该晶体的密度为d g/cm3,阿伏伽德罗常数的值为NA,则晶胞参数a为_________ nm (用含d和NA的代数式表示)
 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+(1)基态Mn原子的价电子排布式为
(2)现代化学中,常利用
(3)已知H2S2O8的结构如图。H2S2O8硫原子的轨道杂化方式为

(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。如图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为

(5)与Mn同周期相邻的元素X,价电子层有2对成对电子,其离子型氧化物晶胞如图所示。它由A、B方块组成。则该氧化物中X2+、X3+、O2-的个数比为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】将汽车尾气中含有的CO利用不仅能有效利用资源.还能防治空气污染。工业上常用CO与H2在由Al、Zn、Cu等元素形成的催化剂作用下合成甲醇。
(1)图l是某同学画出CO分子中碳原子的核外电子排布图。

请判断该排布图____ (填“正确”或“错误”) ,理由是________ (若判断正确,该空不用回答)。
(2)写出两种与CO互为等电子体的离子________ 。
(3)往硫酸铜溶液中通入过量的NH3,可生成配离子[Cu(NH3 )4]2+,但NF3不易与Cu2+形成配离子,其原因是_________ ,在配离子[Cu(NH3 )4]2+中所含配位键是通过配体分子的_____ 给出孤电子对,____ 接受电子对形成。
(4)甲醇与乙烷的相对分子质量相近,故二者分子间的作用力(范德华力)相近,但是二者沸点的差距却很大,造成该差异的原因是______ ;在甲醇分子中碳原子轨道的杂化类型为_____ 。
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图2所示。
①在该晶胞中,Cu+的配位数是_____ 。
②若该晶胞的边长为apm,则Cu2O的密度为_____ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(1)图l是某同学画出CO分子中碳原子的核外电子排布图。

请判断该排布图
(2)写出两种与CO互为等电子体的离子
(3)往硫酸铜溶液中通入过量的NH3,可生成配离子[Cu(NH3 )4]2+,但NF3不易与Cu2+形成配离子,其原因是
(4)甲醇与乙烷的相对分子质量相近,故二者分子间的作用力(范德华力)相近,但是二者沸点的差距却很大,造成该差异的原因是
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图2所示。
①在该晶胞中,Cu+的配位数是
②若该晶胞的边长为apm,则Cu2O的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】碱土金属(ⅡA族)元素单质及其相关化合物的性质、合成一直以来是化学界研究的重点。回答下列问题:
(1)对于碱土金属元素 、
、 、
、 、
、 、
、 ,随着原子序数的增加,以下性质呈单调递减变化的是
,随着原子序数的增加,以下性质呈单调递减变化的是_______ 。
A.原子半径 B.单质的硬度 C.第一电离能
(2)①铍与相邻主族的_______ 元素性质相似。下列有关铍和该元素的叙述正确的有_______ 填标号。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
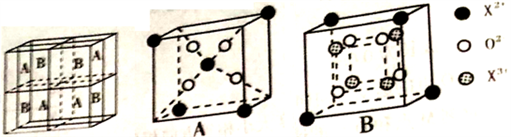
②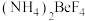 是工业制备金属铍过程中的重要中间产物,其阳离子含有的化学键类型为
是工业制备金属铍过程中的重要中间产物,其阳离子含有的化学键类型为_______ ,阴离子中心原子杂化方式为_______ 。
(3) 位于元素周期表第五周期,第ⅡA主族,是人体必需的微量元素,
位于元素周期表第五周期,第ⅡA主族,是人体必需的微量元素, 是其重要的化合物之一。
是其重要的化合物之一。 的价电子排布式为
的价电子排布式为_______ 。
(4) 和金属
和金属 在一定条件下用球磨机研磨,可制得化学式为
在一定条件下用球磨机研磨,可制得化学式为 的储氢化合物,其立方晶胞结构如图所示:
的储氢化合物,其立方晶胞结构如图所示: 原子周围距离最近且相等的Ni原子有
原子周围距离最近且相等的Ni原子有_______ 个,若晶胞边长为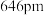 ,则
,则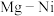 核间距为
核间距为_______ pm(结果保留小数点后两位, 取1.73)。
取1.73)。
②若以晶胞中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则该化合物的储氢能力为_______ (列出计算式即可。假定该化合物中所有的H可以全部放出,液氢密度为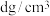 ;设
;设 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。
(1)对于碱土金属元素
 、
、 、
、 、
、 、
、 ,随着原子序数的增加,以下性质呈单调递减变化的是
,随着原子序数的增加,以下性质呈单调递减变化的是A.原子半径 B.单质的硬度 C.第一电离能
(2)①铍与相邻主族的
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
②
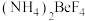 是工业制备金属铍过程中的重要中间产物,其阳离子含有的化学键类型为
是工业制备金属铍过程中的重要中间产物,其阳离子含有的化学键类型为(3)
 位于元素周期表第五周期,第ⅡA主族,是人体必需的微量元素,
位于元素周期表第五周期,第ⅡA主族,是人体必需的微量元素, 是其重要的化合物之一。
是其重要的化合物之一。 的价电子排布式为
的价电子排布式为(4)
 和金属
和金属 在一定条件下用球磨机研磨,可制得化学式为
在一定条件下用球磨机研磨,可制得化学式为 的储氢化合物,其立方晶胞结构如图所示:
的储氢化合物,其立方晶胞结构如图所示:
 原子周围距离最近且相等的Ni原子有
原子周围距离最近且相等的Ni原子有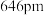 ,则
,则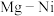 核间距为
核间距为 取1.73)。
取1.73)。②若以晶胞中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则该化合物的储氢能力为
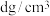 ;设
;设 代表阿伏加德罗常数的值)。
代表阿伏加德罗常数的值)。
您最近一年使用:0次



