硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂。
(1)将Ce(SO4)2·4H2O(摩尔质量为404g/mol)在空气中加热,样品的固体残留率( )随温度的变化如图所示。
)随温度的变化如图所示。
当固体残留率为70.3%时,所得固体可能为______ (填字母)
A. Ce(SO4)2 B. Ce2(SO4)3 C. CeOSO4
(2)将一定质量的Ce(SO4)2·4H2O溶于50mL质量分数为60%、密度为1.47g/cm3的硫酸中,
再用水定容至l000mL,所得溶液中c(H+)=_______ mol/L
(3)利用Ce(SO4)2标准溶液测定FeC2O4·2H2O(摩尔质量为180g/mol)和Fe(C2O4)3·4H2O(摩尔质量为448g/mol)固体混合物中FeC2O4·2H2O含量的方法如下:
步骤l:称量1.1240g固体混合物,溶于硫酸,向溶液中加入100.00mL 0.2000mol/L的Ce(SO4)2溶液。物质转化关系如下: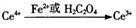
步骤2:将反应后的溶液加水稀释并定容至250.00mL,取25.00mL于锥形瓶中,滴加指示剂,用0.01000mol/LFeSO4标准溶液滴定过量的Ce4+,终点时消耗FeSO4标准溶液20.00mL。
计算固体混合物中FeC2O4·2H2O的质量分数,写出计算过程_______ 。
(1)将Ce(SO4)2·4H2O(摩尔质量为404g/mol)在空气中加热,样品的固体残留率(
 )随温度的变化如图所示。
)随温度的变化如图所示。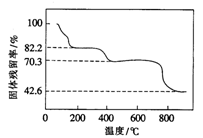
当固体残留率为70.3%时,所得固体可能为
A. Ce(SO4)2 B. Ce2(SO4)3 C. CeOSO4
(2)将一定质量的Ce(SO4)2·4H2O溶于50mL质量分数为60%、密度为1.47g/cm3的硫酸中,
再用水定容至l000mL,所得溶液中c(H+)=
(3)利用Ce(SO4)2标准溶液测定FeC2O4·2H2O(摩尔质量为180g/mol)和Fe(C2O4)3·4H2O(摩尔质量为448g/mol)固体混合物中FeC2O4·2H2O含量的方法如下:
步骤l:称量1.1240g固体混合物,溶于硫酸,向溶液中加入100.00mL 0.2000mol/L的Ce(SO4)2溶液。物质转化关系如下:
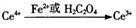
步骤2:将反应后的溶液加水稀释并定容至250.00mL,取25.00mL于锥形瓶中,滴加指示剂,用0.01000mol/LFeSO4标准溶液滴定过量的Ce4+,终点时消耗FeSO4标准溶液20.00mL。
计算固体混合物中FeC2O4·2H2O的质量分数,写出计算过程
更新时间:2017-05-06 21:54:58
|
相似题推荐
计算题
|
较难
(0.4)
名校
【推荐1】向20mL含有1mol/L的氯化铝和一定量盐酸的溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的质量与所加碱的体积如图所示:
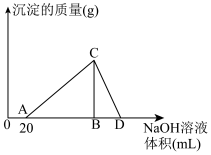
(1)写出AC段和CD段发生反应的离子方程式:
AC_______________________________________
CD_______________________________________
(2)盐酸溶液的浓度是____________________ 。
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是__________________ 。
(4)D点表示的氢氧化钠溶液的体积是______________________ 。

(1)写出AC段和CD段发生反应的离子方程式:
AC
CD
(2)盐酸溶液的浓度是
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是
(4)D点表示的氢氧化钠溶液的体积是
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐2】某同学在实验室将13gZn投入足量稀硫酸中充分反应制取H2,同时得到100g密度为1.25 g/mL的溶液。请计算
(1)可制得标准状况下H2的体积为________ L。
(2)所得溶液中硫酸锌的物质的量浓度为________________ mol/L。
(3)从所得溶液中取出一半,加入0.15mol的BaCl2恰好使硫酸根离子沉淀完全,求原所得溶液中H+物质的量浓度为______________ mol/L。
(1)可制得标准状况下H2的体积为
(2)所得溶液中硫酸锌的物质的量浓度为
(3)从所得溶液中取出一半,加入0.15mol的BaCl2恰好使硫酸根离子沉淀完全,求原所得溶液中H+物质的量浓度为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐3】有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)相同质量的SO2、SO3的物质的量之比为_______ ,氧原子的个数之比为________ 。
(2)0.3 mol NH3分子中所含原子数与________ 个H2O分子中所含原子数相等(NA表示阿伏加德罗常数)。
(3)标准状况下,2.4 g某气体的体积为672 mL,则此气体的相对分子质量为______ 。
(4)含0.4 mol Al3+的Al2(SO4)3中所含的硫酸根离子的物质的量是__________ mol。
(5)100 mL 1.0 mol·L-l 稀硫酸与300 mL 1.0 mol·L-l BaCl2溶液混合,所得溶液中H+ 的物质的量浓度为____ (忽略混合时溶液体积的变化).
(6)某氯化镁溶液的密度为d g/cm3,其中镁离子的质量分数为w,a mL该溶液中Cl— 的物质的量为____ mol.
(7)已知4 mol·L-l 的硫酸溶液密度为ρ1,2 mol·L-l 的硫酸溶液密度为ρ2。100g浓度为4 mol·L-l 的硫酸溶液与____ mL水混合,使硫酸的物质的量浓度减小到2 mol·L-l 。(用含ρ1、ρ2的式子表示).
(1)相同质量的SO2、SO3的物质的量之比为
(2)0.3 mol NH3分子中所含原子数与
(3)标准状况下,2.4 g某气体的体积为672 mL,则此气体的相对分子质量为
(4)含0.4 mol Al3+的Al2(SO4)3中所含的硫酸根离子的物质的量是
(5)100 mL 1.0 mol·L-l 稀硫酸与300 mL 1.0 mol·L-l BaCl2溶液混合,所得溶液中H+ 的物质的量浓度为
(6)某氯化镁溶液的密度为d g/cm3,其中镁离子的质量分数为w,a mL该溶液中Cl— 的物质的量为
(7)已知4 mol·L-l 的硫酸溶液密度为ρ1,2 mol·L-l 的硫酸溶液密度为ρ2。100g浓度为4 mol·L-l 的硫酸溶液与
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐1】已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低。现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示。则:
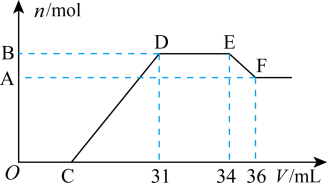
(1)试写出DE段、EF段所发生反应的离子方程式:DE段___________ ;EF段___________ 。
(2)合金中铝的物质的量为___________ mol。
(3)合金中金属的物质的量共为___________ mol。
(4)求出C点的值为___________ ml。

(1)试写出DE段、EF段所发生反应的离子方程式:DE段
(2)合金中铝的物质的量为
(3)合金中金属的物质的量共为
(4)求出C点的值为
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐2】高锰酸钾受热易分解,在不同温度下,发生如下反应:
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
3K2MnO4 2K3MnO4+MnO2+O2↑
2K3MnO4+MnO2+O2↑
已知:M(KMnO4)=158g/mol,M(MnO2)=87g/mol
请回答:
(1)取12.64gKMnO4固体,加热到300℃至完全分解,得到标准状况下O2的体积为___________ mL。
(2)取12.64gKMnO4固体,加热至700℃,一段时间后剩余固体的质量为11.04g,则剩余固体中的MnO2质量为___________ g。
(3)取(2)剩余固体与足量的浓盐酸在加热条件下充分反应,生成Cl2,产物中锰元素以Mn2+存在;则Cl2物质的量为___________ mol。
2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑3K2MnO4
 2K3MnO4+MnO2+O2↑
2K3MnO4+MnO2+O2↑已知:M(KMnO4)=158g/mol,M(MnO2)=87g/mol
请回答:
(1)取12.64gKMnO4固体,加热到300℃至完全分解,得到标准状况下O2的体积为
(2)取12.64gKMnO4固体,加热至700℃,一段时间后剩余固体的质量为11.04g,则剩余固体中的MnO2质量为
(3)取(2)剩余固体与足量的浓盐酸在加热条件下充分反应,生成Cl2,产物中锰元素以Mn2+存在;则Cl2物质的量为
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐1】某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,测量剩余固体的质量随时间的变化关系,如图所示。
(1)t5~ t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色的气体物质的量是___ ;
(2)x∶y=______ 。

(1)t5~ t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色的气体物质的量是
(2)x∶y=
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐2】为探究某盐X(仅含四种元素,其摩尔质量小于300g/mol)设计并完成如下实验:
已知:气体A为单质,标准状况下的密度为1.25g/L。请回答:
(1)盐X的组成元素为H、O和____________ (用元素符号表示)。
(2)写出固体D和过量HI溶液反应的离子方程式__________ 。
(3)写出盐X隔绝空气加热分解的化学方程式__________ 。
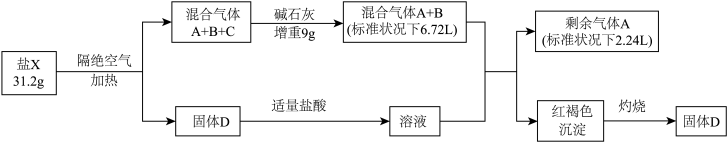
已知:气体A为单质,标准状况下的密度为1.25g/L。请回答:
(1)盐X的组成元素为H、O和
(2)写出固体D和过量HI溶液反应的离子方程式
(3)写出盐X隔绝空气加热分解的化学方程式
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐3】某草酸盐晶体KxFey(C2O4)z•wH2O中铁为+3价,草酸根为-2价,且知x+y+z=7。取该晶体做了以下实验:
① 取4.910g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
加热到300℃以上时,还生成了一种不常见的碳的氧化物气体(用R表示);
② 另取4.910g晶体,经过加酸溶解、加足量碱沉淀、灼烧至恒重,铁元素全部转化为Fe2O3,质量为0.800g。
(1)计算得出草酸盐晶体中结晶水的质量分数为_______ (保留三位小数);
(2)R的化学式为________ ;
(3)草酸盐晶体的摩尔质量为_________ ;
(4)试通过计算,确定草酸盐晶体的化学式__________ 。
① 取4.910g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
| 120℃ | 300℃ | 480℃ | |
| 化学式 | KxFey(C2O4)z | KxFeyO(C2O4)z-1 | KxFeyO2(C2O4)z-2 |
| 质量 | 4.370g | 3.650g | 2.930 g |
加热到300℃以上时,还生成了一种不常见的碳的氧化物气体(用R表示);
② 另取4.910g晶体,经过加酸溶解、加足量碱沉淀、灼烧至恒重,铁元素全部转化为Fe2O3,质量为0.800g。
(1)计算得出草酸盐晶体中结晶水的质量分数为
(2)R的化学式为
(3)草酸盐晶体的摩尔质量为
(4)试通过计算,确定草酸盐晶体的化学式
您最近一年使用:0次



