某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
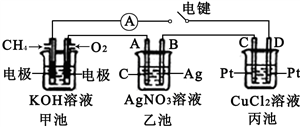
(1)甲池中通入CH4电极的电极反应为___________________________________ 。
(2)乙池中A(石墨)电极的名称为________ (填“正极”、“负极”或“阴极”、“阳极”), 乙池中总反应式为____________________________________ 。
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为______ mL(标准状况),丙池中______ (填“C”或“D”)极析出_______ g铜。

(1)甲池中通入CH4电极的电极反应为
(2)乙池中A(石墨)电极的名称为
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为
更新时间:2017-08-19 13:52:53
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】正确认识和使用电池有利于我们每一个人的日常生活。
I.电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,设计装置如图所示(已知石墨只起导电作用,质子交换膜只允许H+通过)。

(1)石墨1为_____ (填“正极”或“负极”),放电时H+移向____ (填“正极”或“负极”)。
(2)反应的总化学方程式为_____ 。
(3)某同学关于原电池的笔记中,不合理的有____ (填序号)。
①原电池两电极材料活泼性一定不同
②原电池负极材料参与反应,正极材料都不参与反应
③Fe—浓硝酸—Cu原电池,Fe是负极
④原电池是将化学能转变为电能的装置
II.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。
(4)某碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应为_____ 。
(5)氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,当得到1.8g饮用水时,转移的电子数为____ 。
I.电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,设计装置如图所示(已知石墨只起导电作用,质子交换膜只允许H+通过)。

(1)石墨1为
(2)反应的总化学方程式为
(3)某同学关于原电池的笔记中,不合理的有
①原电池两电极材料活泼性一定不同
②原电池负极材料参与反应,正极材料都不参与反应
③Fe—浓硝酸—Cu原电池,Fe是负极
④原电池是将化学能转变为电能的装置
II.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。
(4)某碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应为
(5)氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,当得到1.8g饮用水时,转移的电子数为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。某课外实验小组欲探究铝和铜的金属性(原子失电子能力)强弱,同学们提出了如下实验方案:
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的反应现象
C.将铝片放入硫酸铜溶液,观察铝片上是否有红色物质
D.将铝片、铜片用导线连接后共同投入氢氧化钠溶液中接入电流计,观察电流方向
(1)上述方案中能达到实验目的的是_______ (填字母)。
(2)上述方案D中负极为_______ ,电极反应为_______ 。
(3)将纯锌片和纯铜片按如图所示方式插入500mL相同浓度的稀硫酸一段时间,两烧杯中均产生气泡,有同学认为产生气泡的位置相同,你赞同吗?请写出理由_______ 。

(4)当甲中产生2.24L(标准状况)气体时,将锌、铜片取出(设反应前后溶液体积不变),再将烧杯中的溶液稀释至1L,测得溶液中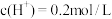 。试确定原稀硫酸的物质的量浓度为
。试确定原稀硫酸的物质的量浓度为_______ mol/L。
(5)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。
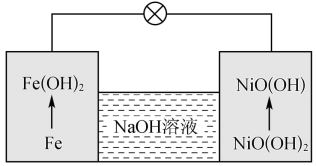
Fe放电生成 后,继续放电时,电极上的
后,继续放电时,电极上的 可转化为
可转化为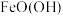 ,写出该过程的电极反应式:
,写出该过程的电极反应式:_______ 。
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的反应现象
C.将铝片放入硫酸铜溶液,观察铝片上是否有红色物质
D.将铝片、铜片用导线连接后共同投入氢氧化钠溶液中接入电流计,观察电流方向
(1)上述方案中能达到实验目的的是
(2)上述方案D中负极为
(3)将纯锌片和纯铜片按如图所示方式插入500mL相同浓度的稀硫酸一段时间,两烧杯中均产生气泡,有同学认为产生气泡的位置相同,你赞同吗?请写出理由

(4)当甲中产生2.24L(标准状况)气体时,将锌、铜片取出(设反应前后溶液体积不变),再将烧杯中的溶液稀释至1L,测得溶液中
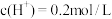 。试确定原稀硫酸的物质的量浓度为
。试确定原稀硫酸的物质的量浓度为(5)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。

Fe放电生成
 后,继续放电时,电极上的
后,继续放电时,电极上的 可转化为
可转化为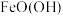 ,写出该过程的电极反应式:
,写出该过程的电极反应式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】C、N、O、Na、Al、Si、S、Cl是常见的八种元素。请回答下列问题:
(1)Si在元素周期表中的位置为___________ ;CO2的电子式是___________ 。
(2)上述元素中原子半径最大的是(写元素符号)___________ ;最高价氧化物对应的水化物酸性最强的是___________ (写化学式)。
(3)下列事实能说明O元素的非金属性比S元素的非金属性强的是___________ 。
a.O2与H2S溶液反应,溶液变浑浊
b.O和S两元素的简单氢化物受热分解,前者的分解温度高
c.在氧化还原反应中,1molO2比1molS得电子多
(4)金刚石具有优良的耐磨,耐腐蚀性,应用广泛。一定条件下,Na还原CCl4可制备金刚石。反应结束冷却至室温后,回收其中的CCl4的实验操作名称为___________ ,除去粗产品中少里钠的试剂为___________ 。
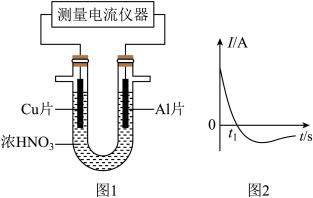
(5)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图l),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。0~t1时,原电池的负极是Al片,此时,正极的电极反应式是___________ ,溶液中的H+向___________ 极移动。t1时,原电池中电子流动方向发生改变,其原因是:___________ 。
(1)Si在元素周期表中的位置为
(2)上述元素中原子半径最大的是(写元素符号)
(3)下列事实能说明O元素的非金属性比S元素的非金属性强的是
a.O2与H2S溶液反应,溶液变浑浊
b.O和S两元素的简单氢化物受热分解,前者的分解温度高
c.在氧化还原反应中,1molO2比1molS得电子多
(4)金刚石具有优良的耐磨,耐腐蚀性,应用广泛。一定条件下,Na还原CCl4可制备金刚石。反应结束冷却至室温后,回收其中的CCl4的实验操作名称为
(5)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图l),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。0~t1时,原电池的负极是Al片,此时,正极的电极反应式是

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.今年新冠疫情期间,某同学为解决环境卫生消毒问题,自行设计了一个84消毒液制备器,如图所示,用石墨作电极电解饱和氯化钠溶液。回答下列问题:

(1)推断电源电极名称:a为___________ 极,电解过程中,与电源正极相连的电极,其电极反应式为___________ 。
(2)产生消毒液过程的有关化学方程式为___________ 和___________ 。
Ⅱ.碘酸钾(KIO3)呈白色,是国家规定的食盐加碘剂。以碘为原料,通过电解制备碘酸钾的实验装置如下图所示。电解前,先将一定量的精制单质碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将所得溶液加入阳极区,另将KOH溶液加入阴极区,电解槽用水冷却。已知:碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。回答下列问题:

(3)电解时,阳极上发生反应的电极反应式为___________ ;阴极上观察到的实验现象是___________ 。
(4)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。设计实验方案为:取少量阳极区电解液于试管中,分别滴加___________ 和___________ (选填试剂代号:①淀粉溶液②碘化钾淀粉试纸③过氧化氢溶液④稀硫酸),若观察到___________ 现象,则说明电解液中还含有I-。

(1)推断电源电极名称:a为
(2)产生消毒液过程的有关化学方程式为
Ⅱ.碘酸钾(KIO3)呈白色,是国家规定的食盐加碘剂。以碘为原料,通过电解制备碘酸钾的实验装置如下图所示。电解前,先将一定量的精制单质碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将所得溶液加入阳极区,另将KOH溶液加入阴极区,电解槽用水冷却。已知:碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。回答下列问题:

(3)电解时,阳极上发生反应的电极反应式为
(4)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。设计实验方案为:取少量阳极区电解液于试管中,分别滴加
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】我国应对气候变化工作成效显著,北京冬奥会是首个实现“碳中和”的世界级体育盛会,我国承诺2030年前实现“碳达峰”,2060年前实现“碳中和”。如何高效利用 是重要的研究课题。
是重要的研究课题。
I.光合作用
(1)植物光合作用中能量的转化形式为_____ 。
(2)“人工树叶”电化学装置如图1所示(以稀硫酸为电解质溶液),该装置能将CO2和H2O转化为糖类(用C6H12O6表示)和O2。
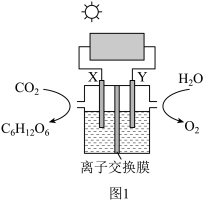
①Y为_____ 极,该极上发生的电极反应式为_____ 。
②室温下,该装置工作一段时间后,电解质溶液的pH_____ (填“升高”“降低”或“不变”)。
Ⅱ.电化学方法可将CO2有效地转化为CH3COOH,装置如图2所示
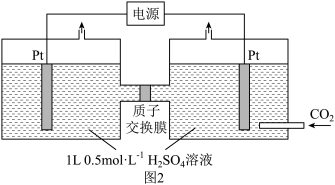
(3)阴极电极反应式为_____ ;电解时,H+通过质子交换膜向_____ 移动(填“左”或“右”)。
 是重要的研究课题。
是重要的研究课题。I.光合作用

(1)植物光合作用中能量的转化形式为
(2)“人工树叶”电化学装置如图1所示(以稀硫酸为电解质溶液),该装置能将CO2和H2O转化为糖类(用C6H12O6表示)和O2。

①Y为
②室温下,该装置工作一段时间后,电解质溶液的pH
Ⅱ.电化学方法可将CO2有效地转化为CH3COOH,装置如图2所示

(3)阴极电极反应式为
您最近一年使用:0次
【推荐3】如图,C、D、E、F、X,Y都是惰性电极,A、B为电源电极。接通电源一段时间后,X极液体颜色变深[Fe(OH)3胶体粒子带正电荷]。

(1)若用甲醇碱性燃料电池作电源,则A极电极反应式为____ 。
(2)若甲中装有100mL0.5mol·L-1硫酸铜溶液,工作一段时间后,当硫酸铜恰好完全被消耗时,停止通电此时测得溶液pH=____ (假设溶液体积不变)。
(3)通电后,检验乙中F极产物的方法是____ 。
(4)欲用丙装置给铁件镀制,则G为____ (填“Fe”或“Cu”)片;阴极反应式为____ ;反应一段时间后(用甲醇碱性燃料电池作电源)铁制品质量增加9.6g,理论上消耗甲醇的质量为____ g。

(1)若用甲醇碱性燃料电池作电源,则A极电极反应式为
(2)若甲中装有100mL0.5mol·L-1硫酸铜溶液,工作一段时间后,当硫酸铜恰好完全被消耗时,停止通电此时测得溶液pH=
(3)通电后,检验乙中F极产物的方法是
(4)欲用丙装置给铁件镀制,则G为
您最近一年使用:0次



