10mL 浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是
| A.K2SO4 | B.H2SO4 | C.CuSO4 | D.Na2CO3 |
更新时间:2017-08-19 15:09:11
|
相似题推荐
单选题
|
容易
(0.94)
名校
解题方法
【推荐1】下列说法正确的是
①增加水的量或升高温度,都可以加快镁跟水的反应速率。
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。
③在可变体积的容器中进行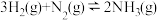 反应,充入氮气化学反应速率一定不改变。
反应,充入氮气化学反应速率一定不改变。
④对于反应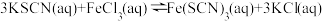 ,加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
,加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
①增加水的量或升高温度,都可以加快镁跟水的反应速率。
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。
③在可变体积的容器中进行
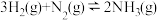 反应,充入氮气化学反应速率一定不改变。
反应,充入氮气化学反应速率一定不改变。④对于反应
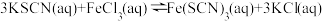 ,加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
,加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大| A.①② | B.①④ | C.②④ | D.无 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】下列关于化学反应速率和碰撞理论的内容,描述正确的是 ( )
| A.对于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,体系温度升高,单位体积的活化分子数增加,活化分子百分数不变,化学反应速率加快 |
B.对于反应N2(g)+3H2(g) 2NH3(g),容器气体压强不变时,充入Ar,单位体积的活化分子数不变,活化分子百分数不变,化学反应速率不变 2NH3(g),容器气体压强不变时,充入Ar,单位体积的活化分子数不变,活化分子百分数不变,化学反应速率不变 |
C.对于反应N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入Ar压强增大,单位体积的活化分子数增加,活化分子百分数增加,化学反应速率加快 2NH3(g),容器体积固定不变时,充入Ar压强增大,单位体积的活化分子数增加,活化分子百分数增加,化学反应速率加快 |
D.对于反应N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入N2压强增大,单位体积的活化分子数增加,活化分子百分数不变,化学反应速率加快 2NH3(g),容器体积固定不变时,充入N2压强增大,单位体积的活化分子数增加,活化分子百分数不变,化学反应速率加快 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
【推荐3】氨是一种重要的化工原料,主要用于化肥工业,也广汤用于硝酸、纯碱、制药等工业;实验室可以用浓氨水和CO制取氦气。工业上合成氨反应为N2(g)+3H2(g) 2NH3(g)。一定温度时,向体积为2L的密闭容器中,充入0.1molN2和0.3molH2。10min时,测得容器中NH3的物质的量浓度为0.04mol/L。下列说法正确的是
2NH3(g)。一定温度时,向体积为2L的密闭容器中,充入0.1molN2和0.3molH2。10min时,测得容器中NH3的物质的量浓度为0.04mol/L。下列说法正确的是
 2NH3(g)。一定温度时,向体积为2L的密闭容器中,充入0.1molN2和0.3molH2。10min时,测得容器中NH3的物质的量浓度为0.04mol/L。下列说法正确的是
2NH3(g)。一定温度时,向体积为2L的密闭容器中,充入0.1molN2和0.3molH2。10min时,测得容器中NH3的物质的量浓度为0.04mol/L。下列说法正确的是| A.0~10min的反应速率v(N2)=0.02mol∙L-1∙min-1 |
| B.10min时,H2的转化率为40% |
| C.10min时,反应前后气体压强之比为5∶1 |
| D.及时将体系中的NH3液化分离出来有利于加快反应速率 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
【推荐1】下列措施能减慢化学反应速率的是
| A.用Zn和2mol·L-1H2SO4反应制取H2时,向溶液中滴加少量CuSO4溶液 |
| B.日常生活中,将食物贮藏在冰箱中 |
| C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末 |
| D.用相同质量的锌粉替代锌粒与同浓度、同体积的盐酸反应制氢气 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】下列做法的目的与反应速率无关的是
| A.将煤块粉碎后燃烧 | B.食盐中添加碘酸钾 |
| C.合成氨反应中加催化剂Fe | D.医护人员冷藏存放“新冠”疫苗 |
您最近一年使用:0次
单选题
|
容易
(0.94)
【推荐1】下列说法中,与盐类水解无关的是
| A.热的纯碱溶液去油污效果好 | B.加热蒸干 溶液,得不到溶质 溶液,得不到溶质 |
| C.实验室氢氧化铁胶体的制备 | D.蘸有氟化钠溶液的铁钉锈蚀速率更快 |
您最近一年使用:0次
单选题
|
容易
(0.94)
解题方法
【推荐2】化学与生产、生活密切相关。下列叙述不正确的是
| A.“保暖贴”在发热过程中应用的是原电池的工作原理 |
| B.医学上常采用硫酸钡作为钡餐,因为硫酸钡难被盐酸溶解 |
C.纯碱可以用作锅炉除垢时 的转化剂 的转化剂 |
D.明矾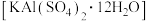 可用作净水剂和消毒剂 可用作净水剂和消毒剂 |
您最近一年使用:0次




