生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式________ 。
(2)根据等电子原理,写出CO分子的结构式______ 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________ ;甲醛分子中碳原子轨道的杂化类型为________ 。
②甲醛分子的空间构型是________ ;1 mol甲醛分子中σ键的数目为________ 。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式
(2)根据等电子原理,写出CO分子的结构式
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是
②甲醛分子的空间构型是
更新时间:2017-08-24 12:50:41
|
【知识点】 价层电子对互斥理论
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】(1) 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为_______ (填化学式,下同),还原性由强到弱的顺序为_______ ,键角由大到小的顺序为_______ 。
(2)常温下,在水中的溶解度乙醇大于氯乙烷,原因是_______ 。
(3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是_______ 。
(4)苯胺(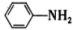 )与甲苯(
)与甲苯( )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______ 。
(5)抗坏血酸的分子结构如图所示,推测抗坏血酸在水中的溶解性:_______ (填“难溶于水”或“易溶于水”)。
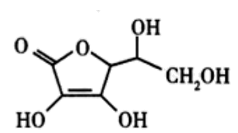
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为(2)常温下,在水中的溶解度乙醇大于氯乙烷,原因是
(3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是
(4)苯胺(
 )与甲苯(
)与甲苯( )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是(5)抗坏血酸的分子结构如图所示,推测抗坏血酸在水中的溶解性:

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】 的
的 模型都是
模型都是_______ ,键角分别是_______ 、_______ 、_______ ;分析它们键角差异的原因:_______ 。
 的
的 模型都是
模型都是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子的空间结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子价层未参与成键的电子对(称为孤电子对), 称为价层电子对数。分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间。
称为价层电子对数。分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间。
Ⅱ、分子的空间结构是指分子中的原子在空间的排布,不包括中心原子未成键的孤电子对。
Ⅲ、分子中价层电子对之间的斥力的主要顺序为:
i、孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的斥力;
ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
iii、X原子得电子能力越弱,A—X形成的共用电子对之间的斥力越强;
iv、其他。
请仔细阅读上述材料,回答下列问题:
(1)由 的
的 模型填写下表:
模型填写下表:
(2)请用 模型解释
模型解释 为直线形分子的原因:
为直线形分子的原因:___________ 。
(3) 分子的空间结构为
分子的空间结构为___________ ,请你预测水分子中 的大小范围并解释原因:
的大小范围并解释原因:___________ 。
(4) 和
和 都属于
都属于 型分子,S、O之间以双键结合,S与
型分子,S、O之间以双键结合,S与 、S与F之间以单键结合。请你预测
、S与F之间以单键结合。请你预测 和
和 分子的空间结构:
分子的空间结构:___________ 。 分子中
分子中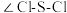
___________ (填“<”“>”或“=”) 分子中
分子中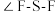 。
。
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子价层未参与成键的电子对(称为孤电子对),
 称为价层电子对数。分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间。
称为价层电子对数。分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间。Ⅱ、分子的空间结构是指分子中的原子在空间的排布,不包括中心原子未成键的孤电子对。
Ⅲ、分子中价层电子对之间的斥力的主要顺序为:
i、孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的斥力;
ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
iii、X原子得电子能力越弱,A—X形成的共用电子对之间的斥力越强;
iv、其他。
请仔细阅读上述材料,回答下列问题:
(1)由
 的
的 模型填写下表:
模型填写下表: | 2 | ① |
| VSEPR模型 | ② | 四面体形 |
| 价层电子对之间的键角 | ③ |  |
 模型解释
模型解释 为直线形分子的原因:
为直线形分子的原因:(3)
 分子的空间结构为
分子的空间结构为 的大小范围并解释原因:
的大小范围并解释原因:(4)
 和
和 都属于
都属于 型分子,S、O之间以双键结合,S与
型分子,S、O之间以双键结合,S与 、S与F之间以单键结合。请你预测
、S与F之间以单键结合。请你预测 和
和 分子的空间结构:
分子的空间结构: 分子中
分子中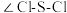
 分子中
分子中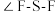 。
。
您最近一年使用:0次



