已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_____________ 。
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:
更新时间:2017-09-22 15:52:20
|
【知识点】 盖斯定律与热化学方程式解读
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】汽车已成为现代社会的重要交通工具之一。它所使用燃料经历了从煤到汽油的变迁。时至今日,人们依然在探索、优化车用燃料。
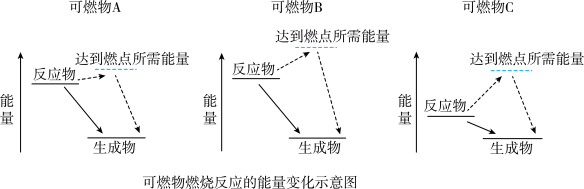
(1)某同学根据所查阅资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图(如图)。根据示意图,你认为哪种物质更适合用作车用燃料______ (填写字母);并说出你的选择依据______ 。
(2)庚烷(C7H16)是汽油的主要成分之一。完全燃烧1g庚烷生成二氧化碳气体和液态水时产生的热量为48kJ。请写出表示庚烷燃烧热的热化学方程式______ ;
(3)目前汽车主要使用燃料为汽油。“辛烷值”用来表示汽油的质量。异辛烷用作抗爆性优良的标准,辛烷值为100。正庚烷用作抗爆性低劣的标准,辛烷值为0。如图是异辛烷的球棍模型:
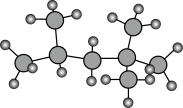
①1mol异辛烷和1mol正庚烷分别完全燃烧生成水和二氧化碳,消耗氧气的质量之差是______ g。
②异辛烷的同分异构体有很多,其中一种同分异构体X,其一氯代物只有一种结构,则X的结构简式为______ 。
(4)车用燃料在使用过程中会产生汽车尾气(主要含有一氧化碳,一氧化氮),是造成空气污染的主要因素之一。可在汽车尾气系统中安装催化转化器,使CO和NO在催化剂的作用下反应生成两种无污染的气体。其中,氮气和氧气反应生成一氧化氮的能量变化如图所示,则由该反应生成2mol NO(g),对应热化学方程式的△H=______

(1)某同学根据所查阅资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图(如图)。根据示意图,你认为哪种物质更适合用作车用燃料

(2)庚烷(C7H16)是汽油的主要成分之一。完全燃烧1g庚烷生成二氧化碳气体和液态水时产生的热量为48kJ。请写出表示庚烷燃烧热的热化学方程式
(3)目前汽车主要使用燃料为汽油。“辛烷值”用来表示汽油的质量。异辛烷用作抗爆性优良的标准,辛烷值为100。正庚烷用作抗爆性低劣的标准,辛烷值为0。如图是异辛烷的球棍模型:

①1mol异辛烷和1mol正庚烷分别完全燃烧生成水和二氧化碳,消耗氧气的质量之差是
②异辛烷的同分异构体有很多,其中一种同分异构体X,其一氯代物只有一种结构,则X的结构简式为
(4)车用燃料在使用过程中会产生汽车尾气(主要含有一氧化碳,一氧化氮),是造成空气污染的主要因素之一。可在汽车尾气系统中安装催化转化器,使CO和NO在催化剂的作用下反应生成两种无污染的气体。其中,氮气和氧气反应生成一氧化氮的能量变化如图所示,则由该反应生成2mol NO(g),对应热化学方程式的△H=

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】I.写出下列反应的热化学方程式。
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是___________ 。
(2)在1.01×105 Pa时,16 g S固体在足量的氧气中充分燃烧生成二氧化硫,放出148.5 kJ的热量,则S固体燃烧热的热化学方程式为_____________ 。 (S相对原子质量为32)
II.研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(3)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S固体。已知:
①CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是___________ 。
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是
(2)在1.01×105 Pa时,16 g S固体在足量的氧气中充分燃烧生成二氧化硫,放出148.5 kJ的热量,则S固体燃烧热的热化学方程式为
II.研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(3)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S固体。已知:
①CO(g)+
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】工业及汽车尾气已成为城市空气的主要污染源,研究其反应机理对于环境治理有重要意义。
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0 kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ/mol
4NO2(g)+O2(g)+2H2O(g)=4HNO3(g) △H=___________ kJ/mol。
(2)液氨催化还原NO是重要的烟气脱硝技术。使用Fe2O3为催化剂,可能的反应过程如图所示。___________ 。
②反应过程图中,虚线方框里的过程可描述为___________ 。
③氨氮比会直接影响该方法的脱硝率。350℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系如图所示。当 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是___________ 。
NO2被Na2CO3溶液吸收生成的三种盐分别是NaNO2、NaNO3和___________ 。(填化学式)
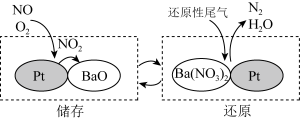
(4)NSR (NOX储存还原)可有效减少氮氧化物排放。工作原理:通过BaO和Ba(NO3)2的相互转化实现NOX的储存和还原,如图所示。___________ 。
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0 kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ/mol
4NO2(g)+O2(g)+2H2O(g)=4HNO3(g) △H=
(2)液氨催化还原NO是重要的烟气脱硝技术。使用Fe2O3为催化剂,可能的反应过程如图所示。
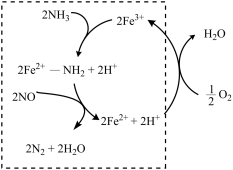
②反应过程图中,虚线方框里的过程可描述为
③氨氮比会直接影响该方法的脱硝率。350℃时只改变氨气的投放量,NO的百分含量与氨氮比的关系如图所示。当
 >1.0时,烟气中NO含量反而增大,主要原因是
>1.0时,烟气中NO含量反而增大,主要原因是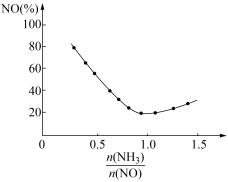
NO2被Na2CO3溶液吸收生成的三种盐分别是NaNO2、NaNO3和
(4)NSR (NOX储存还原)可有效减少氮氧化物排放。工作原理:通过BaO和Ba(NO3)2的相互转化实现NOX的储存和还原,如图所示。
您最近一年使用:0次



