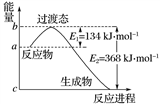
(1)如图所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_______________________________________ 。
(2)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25 kJ· mol-1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ· mol-1
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+19 kJ· mol-1
请写出CO还原FeO的热化学方程式:__________________________________ 。

(2)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25 kJ· mol-1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ· mol-1
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+19 kJ· mol-1
请写出CO还原FeO的热化学方程式:
更新时间:2017-09-21 19:10:05
|
【知识点】 盖斯定律与热化学方程式解读
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)化学反应都伴随有能量变化。下列反应中的能量变化符合如图的有____ (填序号)。

a.铵根离子的水解反应
b.二氧化氮转化为四氧化二氮的反应
c.碳与水蒸气的反应
(2)若如图表示常温常压下,1 mol NO2和1 mol CO完全反应生成CO2和NO过程中的能量变化,曲线II表示_____ (填“有”或“无”)催化剂作用时的能量变化。如果能量变化如曲线I所示,则该反应的热化学方程式为____ ,该反应的逆反应的活化能为____ kJ·mol-1;若常温常压下,1 mol CO完全燃烧放出的热量为E3 kJ,则2NO(g)+O2(g)=2NO2(g) △H=____ kJ·mol-1(结合图示解答)。
(1)化学反应都伴随有能量变化。下列反应中的能量变化符合如图的有

a.铵根离子的水解反应
b.二氧化氮转化为四氧化二氮的反应
c.碳与水蒸气的反应
(2)若如图表示常温常压下,1 mol NO2和1 mol CO完全反应生成CO2和NO过程中的能量变化,曲线II表示
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mo)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置
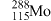 的中子数为
的中子数为已知:
P(s,白磷)=P(s,黑磷) 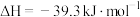 ;
;
P(s,白磷)=P(s,红磷) 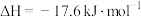 ;
;
由此推知,其中最稳定的磷单质是
(2)氮和磷氢化物性质的比较:
热稳定性:

沸点:
 。
。
(3)
 和
和 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对 与HI反应产物的推断正确的是
与HI反应产物的推断正确的是a.不能与NaOH反应 b.含离子键、共价键 c.其溶液显碱性
(4)
 能发生较强烈的水解,生成难溶的SbOCl,因此,配制
能发生较强烈的水解,生成难溶的SbOCl,因此,配制 溶液应注意
溶液应注意(5)解释碳酸钠溶液显碱性的原因
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】根据要求回答问题:
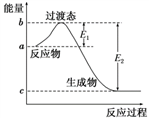
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________ (填“增大”“减小”或“不变”,下同),ΔH的变化是________ 。
(2)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________ 。
(3)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为____________________________________________________________________ 。
(4)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。这两步的能量变化如图:
。这两步的能量变化如图:
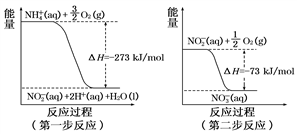
第二步反应是__________ 反应(填“放热”或“吸热”)。1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO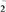 (aq)的热化学方程式是
(aq)的热化学方程式是_____________________ 。
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是

(2)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为
(3)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+
 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为
(4)在微生物作用的条件下,NH
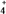 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。这两步的能量变化如图:
。这两步的能量变化如图:
第二步反应是
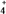 (aq)全部氧化成NO
(aq)全部氧化成NO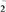 (aq)的热化学方程式是
(aq)的热化学方程式是
您最近一年使用:0次



