氯碱厂电解饱和食盐水制取NaOH的化学反应方程式为:2NaCl + H2O 2NaOH + H2↑+ Cl2↑,工艺流程示意图如下:
2NaOH + H2↑+ Cl2↑,工艺流程示意图如下:
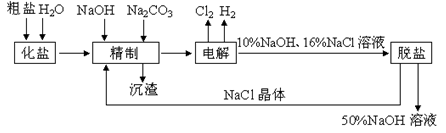
下表是NaCl和MaOH在水中的溶解度
依据示意图和表,完成下列填空:
(1)工业食盐中含CaCl2、MgCl2等杂质。除去Ca2+、Mg2+过程发生反应的化学反应方程式为_____ 。
(2)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______ 、冷却、______ (填写操作名称)除去NaCl。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是________ (填字母序号)。
①Ba(NO3)2②BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_______ (少选多选都不计分)。
A.先加NaOH,后加Na2CO3,再加钡试剂 B.先加Na2CO3,后加钡试剂,再加NaOH
C.先加钡试剂,后加NaOH,再加Na2CO3 D.先加NaOH,后加钡试剂,再加Na2CO3
(5)用制得的 NaOH固体配制 240 mL0.2mol/L NaOH 溶液。
①配制时,必须使用的玻璃仪器有______________________ 。
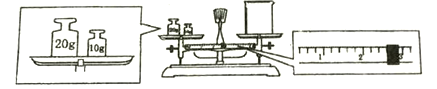
②某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。
烧杯的实际质量为________________ g。
③在配制过程中,其他操作都是正确的,下列情况对所配制的NaOH珩液的浓度偏高有_____ 。
A.没有洗涤烧杯和玻璃棒 B.容量瓶不干燥,含有少量蒸馏水
C.定容时俯视刻度线 D.定容时仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
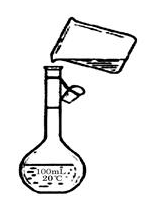
④下图是该同学转移溶液的示意图,图中的错误是_____________ 。
 2NaOH + H2↑+ Cl2↑,工艺流程示意图如下:
2NaOH + H2↑+ Cl2↑,工艺流程示意图如下:
下表是NaCl和MaOH在水中的溶解度
| 温度 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| NaCl | 35.7g | 36g | 36.6g | 37.3g | 38.4g | 39.8g |
| NaOH | 42g | 109g | 129g | 174g | 314g | 347g |
依据示意图和表,完成下列填空:
(1)工业食盐中含CaCl2、MgCl2等杂质。除去Ca2+、Mg2+过程发生反应的化学反应方程式为
(2)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
①Ba(NO3)2②BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
A.先加NaOH,后加Na2CO3,再加钡试剂 B.先加Na2CO3,后加钡试剂,再加NaOH
C.先加钡试剂,后加NaOH,再加Na2CO3 D.先加NaOH,后加钡试剂,再加Na2CO3
(5)用制得的 NaOH固体配制 240 mL0.2mol/L NaOH 溶液。
①配制时,必须使用的玻璃仪器有
②某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。
烧杯的实际质量为

③在配制过程中,其他操作都是正确的,下列情况对所配制的NaOH珩液的浓度偏高有
A.没有洗涤烧杯和玻璃棒 B.容量瓶不干燥,含有少量蒸馏水
C.定容时俯视刻度线 D.定容时仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
④下图是该同学转移溶液的示意图,图中的错误是

更新时间:2017-10-26 15:40:32
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】I.某“84”消毒液部分标签如下,回答下列问题:
(1)某实验需用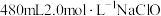 消毒液,现用
消毒液,现用 固体配制。
固体配制。
a.需要用托盘天平称量 固体的质量为
固体的质量为_______
b.配制时,一般可分为以下几个步骤,正确的操作顺序为_______ 。
①称量②计算③溶解④摇匀⑤移液⑥洗涤⑦定容⑧冷却
(2)在配制过程中,除需要烧杯、托盘天平外还必需的仪器有_______ 。
(3)下列操作可能使配制溶液浓度偏低的是_______ (填字母)。
A.移液时,未洗涤烧杯内壁和玻璃棒 B.溶解后未经冷却就移液
C.移液时,有少量液体溅出 D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
II.食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关,25℃时,HAc的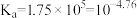 。
。
(4)配制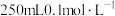 的HAc溶液,需
的HAc溶液,需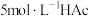 溶液的体积为
溶液的体积为_______ mL。
(5)下列关于250mL容量瓶的操作,正确的是_______
(6)某小组研究25℃下HAc电离平衡的影响因素。
提出假设。稀释HAc溶液或改变 浓度,HAc电离平衡会发生移动。设计方案并完成实验用浓度均为
浓度,HAc电离平衡会发生移动。设计方案并完成实验用浓度均为 的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
①根据表中信息,补充数据:_______ ,_______ 。
②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡_______ (填“正”或“逆”)向移动,结合表中数据,给出判断理由:_______
③由实验Ⅱ—Ⅷ 可知,增大 浓度,HAc电离平衡逆向移动。
浓度,HAc电离平衡逆向移动。
实验结论假设成立。
| 净含量: 500mL 密度:1.19g·cm-3 主要成分:25%NaClO ( NaClO的摩尔质量为74.5g· mol-1) 注意事项:密封保存 |
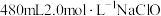 消毒液,现用
消毒液,现用 固体配制。
固体配制。a.需要用托盘天平称量
 固体的质量为
固体的质量为b.配制时,一般可分为以下几个步骤,正确的操作顺序为
①称量②计算③溶解④摇匀⑤移液⑥洗涤⑦定容⑧冷却
(2)在配制过程中,除需要烧杯、托盘天平外还必需的仪器有
(3)下列操作可能使配制溶液浓度偏低的是
A.移液时,未洗涤烧杯内壁和玻璃棒 B.溶解后未经冷却就移液
C.移液时,有少量液体溅出 D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
II.食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关,25℃时,HAc的
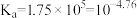 。
。(4)配制
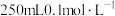 的HAc溶液,需
的HAc溶液,需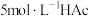 溶液的体积为
溶液的体积为(5)下列关于250mL容量瓶的操作,正确的是_______
A. | B. | C. | D. |
提出假设。稀释HAc溶液或改变
 浓度,HAc电离平衡会发生移动。设计方案并完成实验用浓度均为
浓度,HAc电离平衡会发生移动。设计方案并完成实验用浓度均为 的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。| 序号 | V (HAc)/mL | V(NaAc)/mL | V(H2O)/mL | n(NaAc):n(HAc) | pH |
| Ⅰ | 40.00 | / | / | 0 | 2.86 |
| Ⅱ | 4.00 | / | 36.0 | 0 | 3.36 |
| … | |||||
| Ⅶ | 4.00 | a | b | 3:4 | 4.53 |
| Ⅷ | 4.00 | 4.00 | 32.0 | 1:1 | 4.65 |
②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡
③由实验Ⅱ—Ⅷ 可知,增大
 浓度,HAc电离平衡逆向移动。
浓度,HAc电离平衡逆向移动。实验结论假设成立。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】(硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
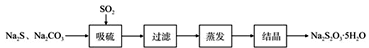
(1)吸硫装置如图所示

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是______ ,表明SO2吸收效率低的实验现象是B中溶液 _________ 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是___________________ 。(答一条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。请完成该实验方案。(已知:室温时CaCO3饱和溶液的pH=10.2)
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(化学式量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=___ mol·L-1。
(4)在(3)的实验中,某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能___________ (填“不受影响”、“偏低”或“偏高”),原因是_____________ 。(用离子方程式表示)。(已知:IO3-+5I-+6H+= 3I2+3H2O, 4I-+O2+4H+=I2+2H2O ,2S2O32-+I2=S4O62-+2I-)

(1)吸硫装置如图所示

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。请完成该实验方案。(已知:室温时CaCO3饱和溶液的pH=10.2)
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解, | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
第一步:准确称取a g KIO3(化学式量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=
(4)在(3)的实验中,某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】浓硫酸是常用的干燥剂,根据需要可将浓硫酸配成不同浓度的稀硫酸。回答下列问题:
(1)
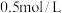 的
的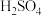 溶液中含有
溶液中含有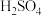
______ g,含有
______ 个,将此溶液与足 量的铝片反应,生成的气体在标准状况下体积为______ L。
(2)配制上述稀硫酸需要量取质量分数为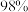 ,密度为
,密度为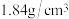 的浓硫酸
的浓硫酸_____ mL 结果保留一位小数
结果保留一位小数 。配制此溶液需要的玻璃仪器除了烧杯、玻璃棒、胶头滴管外还需要
。配制此溶液需要的玻璃仪器除了烧杯、玻璃棒、胶头滴管外还需要______________________________ 。
(3)稀释浓硫酸的操作是_________________________________________________ 。
(4)下列操作使配制的硫酸溶液的物质的量浓度偏小的是______ 。
A.稀释浓硫酸时有液体溅出
B.容量瓶中有少量蒸馏水残留
C.浓硫酸稀释后溶液没有冷却到室温就转移
D.向容量瓶加水定容时仰视刻度线
(1)

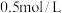 的
的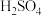 溶液中含有
溶液中含有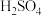

(2)配制上述稀硫酸需要量取质量分数为
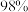 ,密度为
,密度为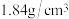 的浓硫酸
的浓硫酸 结果保留一位小数
结果保留一位小数 。配制此溶液需要的玻璃仪器除了烧杯、玻璃棒、胶头滴管外还需要
。配制此溶液需要的玻璃仪器除了烧杯、玻璃棒、胶头滴管外还需要(3)稀释浓硫酸的操作是
(4)下列操作使配制的硫酸溶液的物质的量浓度偏小的是
A.稀释浓硫酸时有液体溅出
B.容量瓶中有少量蒸馏水残留
C.浓硫酸稀释后溶液没有冷却到室温就转移
D.向容量瓶加水定容时仰视刻度线
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】(1)请按要求填空:用已准确称量的Na2CO3固体配制0.10mol/L Na2CO3溶液100mL,所需要的仪器除烧杯、量筒、玻璃棒和胶头滴管外,还需要的仪器为__________________ 。
(2)实验室可用下图装置(加热装置略)制取SO2以及验证SO2性质
①甲装置中制取SO2气体的化学方程式是___________________________________ 。
②为了证明SO2具有酸性,a处可放置_________ 试纸;装置乙中现象为溶液褪色,可证明SO2具有________ 性。
③ 丙装置的作用是_______________________________ 。
(2)实验室可用下图装置(加热装置略)制取SO2以及验证SO2性质
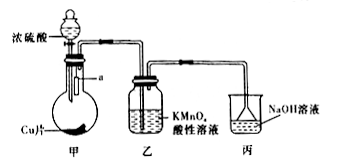
①甲装置中制取SO2气体的化学方程式是
②为了证明SO2具有酸性,a处可放置
③ 丙装置的作用是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
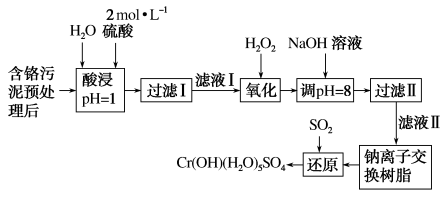
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②Cr2O72-+H2O⇌2CrO42-+2H+
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)实验室用18.4mol·L-1的浓硫酸配制480mL2mol·L-1的硫酸,配制时所用玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需_______ 。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_______ 。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为______ (填微粒的化学式)。
(4)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有_____ 。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:_____ 。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用0.1000mol·L-1AgNO3标准溶液滴定待测液,已知:
①滴定时可选为滴定指示剂的是_______ (填编号),滴定终点的现象是_______ 。
A.NaCl B.K2CrO4 C.KI D.NaCN
②取某废水25.00ml,滴定终点时消耗AgNO3标准溶液10.00ml,则废水中SCN-的物质的量浓度为_______ 。

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②Cr2O72-+H2O⇌2CrO42-+2H+
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 |
(1)实验室用18.4mol·L-1的浓硫酸配制480mL2mol·L-1的硫酸,配制时所用玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为
(4)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用0.1000mol·L-1AgNO3标准溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
A.NaCl B.K2CrO4 C.KI D.NaCN
②取某废水25.00ml,滴定终点时消耗AgNO3标准溶液10.00ml,则废水中SCN-的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】某化学兴趣小组利用铜跟浓硫酸反应,探究 的部分性质,并利用
的部分性质,并利用 制备食品抗氧化剂焦亚硫酸钠(
制备食品抗氧化剂焦亚硫酸钠( )。已知
)。已知 溶于水即生成
溶于水即生成 。
。
I.制取 并探究其性质
并探究其性质

(1)装置A中发生反应的化学方程式为___________ 。
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是___________ (填序号):
①水 ②饱和的 溶液 ③饱和的
溶液 ③饱和的 溶液 ④酸性
溶液 ④酸性
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于 与溶液中的
与溶液中的 反应使碱性减弱,而D中则是由于
反应使碱性减弱,而D中则是由于 具有
具有___________ 性。
(4)若实验中用一定质量的铜片和
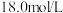 的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为
的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为 ,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾___________ mol。
Ⅱ.焦亚硫酸钠的应用及含量测定
(5)向某些饮料中添加少量焦亚硫酸钠( ),可降低饮料中溶解氧的含量,发生反应的离子方程式为
),可降低饮料中溶解氧的含量,发生反应的离子方程式为___________ 。
(6)测定某葡萄酒中 残留量的方案为:取葡萄酒样品
残留量的方案为:取葡萄酒样品 ,加入盐酸充分蒸馏,向馏分中用
,加入盐酸充分蒸馏,向馏分中用 标准
标准 溶液进行滴定(反应方程式为
溶液进行滴定(反应方程式为 ),消耗标准
),消耗标准 溶液
溶液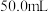 。
。
若需配制
 标准
标准 溶液,需要的玻璃仪器有烧杯、玻璃棒、
溶液,需要的玻璃仪器有烧杯、玻璃棒、___________ 。计算样品中抗氧化剂的残留量(以 计)为
计)为___________  。
。
 的部分性质,并利用
的部分性质,并利用 制备食品抗氧化剂焦亚硫酸钠(
制备食品抗氧化剂焦亚硫酸钠( )。已知
)。已知 溶于水即生成
溶于水即生成 。
。I.制取
 并探究其性质
并探究其性质
(1)装置A中发生反应的化学方程式为
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是
①水 ②饱和的
 溶液 ③饱和的
溶液 ③饱和的 溶液 ④酸性
溶液 ④酸性
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于
 与溶液中的
与溶液中的 反应使碱性减弱,而D中则是由于
反应使碱性减弱,而D中则是由于 具有
具有(4)若实验中用一定质量的铜片和

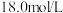 的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为
的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为 ,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾Ⅱ.焦亚硫酸钠的应用及含量测定
(5)向某些饮料中添加少量焦亚硫酸钠(
 ),可降低饮料中溶解氧的含量,发生反应的离子方程式为
),可降低饮料中溶解氧的含量,发生反应的离子方程式为(6)测定某葡萄酒中
 残留量的方案为:取葡萄酒样品
残留量的方案为:取葡萄酒样品 ,加入盐酸充分蒸馏,向馏分中用
,加入盐酸充分蒸馏,向馏分中用 标准
标准 溶液进行滴定(反应方程式为
溶液进行滴定(反应方程式为 ),消耗标准
),消耗标准 溶液
溶液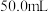 。
。若需配制

 标准
标准 溶液,需要的玻璃仪器有烧杯、玻璃棒、
溶液,需要的玻璃仪器有烧杯、玻璃棒、 计)为
计)为 。
。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下列实验。
①称取m g草酸晶体,配成100.0 mL溶液。
②取25.0 mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1 KMnO4溶液滴定。滴定时,所发生反应为:2KMnO4+5H2C2O4+3H2SO4===K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有:天平(含砝码)、烧杯、药匙、胶头滴管和____________ 、____________ 。
(2)在实验②中,滴定时KMnO4溶液应装在________ 式滴定管中,锥形瓶中________ (填“需要”或 “不需要”)滴加指示剂。
(3)在滴定过程中,目光应注视______________________ 。
(4)某学生实验时用草酸润洗了锥形瓶测定的浓度会偏_____ 。(填“偏高”、“偏低”或“无影响”)
①称取m g草酸晶体,配成100.0 mL溶液。
②取25.0 mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1 KMnO4溶液滴定。滴定时,所发生反应为:2KMnO4+5H2C2O4+3H2SO4===K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有:天平(含砝码)、烧杯、药匙、胶头滴管和
(2)在实验②中,滴定时KMnO4溶液应装在
(3)在滴定过程中,目光应注视
(4)某学生实验时用草酸润洗了锥形瓶测定的浓度会偏
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】实验室现需配制物质的量浓度为1 mol·L-1的NaOH溶液480 mL。
(1)配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入________________;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2 cm时,改用___________滴加蒸馏水至凹液面与刻度线相切。
①实验过程中用到的玻璃仪器 有:烧杯、量筒、玻璃棒、_____________ 、________ 。
②上述步骤的正确操作顺序是__________________________________ 。
(2)要配制此溶液,需要称量NaOH固体的质量为____________ 克。
(3)下列操作会使所配制溶液浓度偏大的有__________________ 。
(4)配制好的NaOH溶液不能用带磨口玻璃塞的试剂瓶存放,请用化学方程式解释原因________________________________________________ 。
(1)配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入________________;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2 cm时,改用___________滴加蒸馏水至凹液面与刻度线相切。
①实验过程中用到的
②上述步骤的正确操作顺序是
(2)要配制此溶液,需要称量NaOH固体的质量为
(3)下列操作会使所配制溶液浓度偏大的有
A.溶解固体溶质时,未冷却至室温即转入容量瓶进行定容
B.定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时观察液面仰视
(4)配制好的NaOH溶液不能用带磨口玻璃塞的试剂瓶存放,请用化学方程式解释原因
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】实验室欲配制1mol/L NaOH溶液240ml,请回答:
(1)需称取NaOH固体____________ g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小___________ (填字母),并在下图中选出能正确表示游码位置的选项____________ (填字母)。
附表砝码规格

(2)选用的主要玻璃仪器除烧杯、玻璃棒外还有_____________________________ 。
(3)下列操作的顺序是(用序号表示)_________________ 。
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)下列情况对所配制的NaOH溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏洗涤后残留有少量的水________________
②将热的溶液直接移入了容量瓶________________
③定容时,仰视容量瓶的刻度线________________
④转移溶液时,玻璃棒的下端在容量瓶的刻度线以上________________
(1)需称取NaOH固体
附表砝码规格
| a | b | c | d | e | |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |

(2)选用的主要玻璃仪器除烧杯、玻璃棒外还有
(3)下列操作的顺序是(用序号表示)
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)下列情况对所配制的NaOH溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏洗涤后残留有少量的水
②将热的溶液直接移入了容量瓶
③定容时,仰视容量瓶的刻度线
④转移溶液时,玻璃棒的下端在容量瓶的刻度线以上
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】二苯酮( )是一种重要的有机合成原料,可用作香料定香剂、紫外线吸收剂。实验室制各过程和有关数据如下所示:
)是一种重要的有机合成原料,可用作香料定香剂、紫外线吸收剂。实验室制各过程和有关数据如下所示:

 ,四氯化碳的密度为1.594
,四氯化碳的密度为1.594 。
。回答下列问题:
(1)制各二苯酮粗产品的装置如图所示(控温装置和夹持装置已略去)。

②写出本制备装置的缺陷并说明原因:
(2)从节约实验试剂的原则考虑,“操作2”的萃取剂宜采用
(3)“操作4”中加入无水
 的主要目的是
的主要目的是(4)
 水解制二苯酮的化学方程式为
水解制二苯酮的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】斑铜矿(主要成分是Cu5FeS4,含少量SiO2)是自然界中最丰富的含铜矿物之一,以斑铜矿为原料可实现如下转化。
②Cu+酸性条件发生自身氧化还原反应生成Cu2+和Cu。
③ 加热时易失去NH3。
加热时易失去NH3。
请回答:
(1)①溶液A中加试剂X可实现FeCl3的循环利用,则试剂X是_______ 。
②固体C可通过溶解、过滤、蒸馏等操作分离出硫单质,溶解时最适宜的溶剂为_______ 。
A.水 B.NaOH溶液 C.CS2 D.酒精
(2)步骤Ⅱ需快速将固体B投入到NaCl溶液中,原因是_______ 。
(3)写出溶液D中的所有阳离子_______ 。
(4)写出反应I的离子方程式_______ 。
(5)将斑铜矿在有氧条件下用氨水浸出,可制得 晶体,反应原理为
晶体,反应原理为 (未配平)。设计由浸出液制取
(未配平)。设计由浸出液制取 晶体的实验方案:
晶体的实验方案:_______ 。

②Cu+酸性条件发生自身氧化还原反应生成Cu2+和Cu。
③
 加热时易失去NH3。
加热时易失去NH3。请回答:
(1)①溶液A中加试剂X可实现FeCl3的循环利用,则试剂X是
②固体C可通过溶解、过滤、蒸馏等操作分离出硫单质,溶解时最适宜的溶剂为
A.水 B.NaOH溶液 C.CS2 D.酒精
(2)步骤Ⅱ需快速将固体B投入到NaCl溶液中,原因是
(3)写出溶液D中的所有阳离子
(4)写出反应I的离子方程式
(5)将斑铜矿在有氧条件下用氨水浸出,可制得
 晶体,反应原理为
晶体,反应原理为 (未配平)。设计由浸出液制取
(未配平)。设计由浸出液制取 晶体的实验方案:
晶体的实验方案:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】以软锰矿(主要含有MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备KMnO4的工艺流程如图所示:
①25℃时,Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
②H2CO3的电离常数:Ka1=4.4×10-7,Ka2 =4.7×10-11;NH3·H2O的电离常数:Kb =1.8×10-5
③当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。
回答下列问题:
(1)Mn在元素周期表中位于_______ 区,核外电子占据最高能层的符号是_______ ,金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用_______ “理论”解释。
(2)“浸取”时Na2SO3将MnO2转化为Mn2+,该反应的离子方程式为_______ 。
(3)“除Fe、Al、Si”时,将Fe2+氧化为Fe3+后,再向该溶液中加入Mn(OH)2调节pH,则使Fe3+沉淀完全的pH的最小值为_______ 。
(4)“除Ca、Mg”时,所得滤液中 =
=_______ 。
(5)“沉锰”时,NH4HCO3溶液作“沉锰”试剂。
①NH4HCO3的水溶液中c(HCO )、c(NH
)、c(NH )、c(H+)、c(OH-)从大到小的顺序为
)、c(H+)、c(OH-)从大到小的顺序为_______ 。
②“沉锰”时,“锰”转化为MnCO3,反应的离子方程式为_______ 。
(6)工业上常用铁和石墨做电极材料,电解锰酸钾(K2MnO4)溶液制备高锰酸钾。
①铁为_______ (填“阴极”或“阳极”)。
②阳极的电极反应式为_______ 。

①25℃时,Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
②H2CO3的电离常数:Ka1=4.4×10-7,Ka2 =4.7×10-11;NH3·H2O的电离常数:Kb =1.8×10-5
③当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。
回答下列问题:
(1)Mn在元素周期表中位于
(2)“浸取”时Na2SO3将MnO2转化为Mn2+,该反应的离子方程式为
(3)“除Fe、Al、Si”时,将Fe2+氧化为Fe3+后,再向该溶液中加入Mn(OH)2调节pH,则使Fe3+沉淀完全的pH的最小值为
(4)“除Ca、Mg”时,所得滤液中
 =
=(5)“沉锰”时,NH4HCO3溶液作“沉锰”试剂。
①NH4HCO3的水溶液中c(HCO
 )、c(NH
)、c(NH )、c(H+)、c(OH-)从大到小的顺序为
)、c(H+)、c(OH-)从大到小的顺序为②“沉锰”时,“锰”转化为MnCO3,反应的离子方程式为
(6)工业上常用铁和石墨做电极材料,电解锰酸钾(K2MnO4)溶液制备高锰酸钾。
①铁为
②阳极的电极反应式为
您最近一年使用:0次



