Ⅰ.(1)当1 g氨气完全分解为N2和H2时,吸收2.7kJ的热量,写出其热化学方程式:___________________________________________________________ 。
(2)HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和NaOH反应的中和热的热化学方程式为____________________________________________ 。
Ⅱ.已知下列反应,回答下列问题:
2CO(g)+O2(g)=2CO2(g) △H=﹣566kJ/mol ①
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) △H=﹣266kJ/mol ②
O2(g) △H=﹣266kJ/mol ②
(1)CO的燃烧热为______________ 。
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:______________________________________________________________ 。
(3)已知反应①中的相关的化学键键能数据如下:则a=____________ kJ/mol
(2)HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和NaOH反应的中和热的热化学方程式为
Ⅱ.已知下列反应,回答下列问题:
2CO(g)+O2(g)=2CO2(g) △H=﹣566kJ/mol ①
Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g) △H=﹣266kJ/mol ②
O2(g) △H=﹣266kJ/mol ②(1)CO的燃烧热为
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:
(3)已知反应①中的相关的化学键键能数据如下:则a=
| 化学键 | C=O(CO2) | C  O(CO) O(CO) | O=O |
| E/(kJ.mol-1) | 803.5 | 1076 | a |
更新时间:2017-11-17 19:22:47
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)火箭推进剂中较普遍的组合是肼( )和
)和 ,两者反应生成
,两者反应生成 和水蒸气。已知:
和水蒸气。已知:
①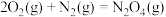
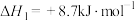
②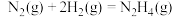
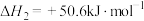
③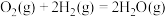
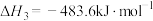
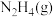 和
和 反应的热化学方程式为
反应的热化学方程式为_______
(2)拆开1mol共价键所吸收的能量或形成1mol共价键所释放的能量称为键能。已知H-H键能为436 ,H-N键能为391
,H-N键能为391 ,
, 键能为946
键能为946 。则工业合成氨的热化学方程式为
。则工业合成氨的热化学方程式为_______ 。
(3) 溶液常用于腐蚀印刷电路铜板,发生
溶液常用于腐蚀印刷电路铜板,发生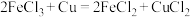 ,若将此反应设计成原电池,则负极所用电极材料为
,若将此反应设计成原电池,则负极所用电极材料为_______ ,当线路中转移0.4mol电子时,则被腐蚀铜的质量为_______ g。
(4)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

①B为生物燃料电池的_______ (填“正”或“负”)极。
②正极反应式为_______ 。
③电池工作过程中, 将移向
将移向_______ (填“正”或“负”)极。
④在电池反应中,每消耗1mol氧气,理论上生成标准状况下二氧化碳的体积是_______ L。
(1)火箭推进剂中较普遍的组合是肼(
 )和
)和 ,两者反应生成
,两者反应生成 和水蒸气。已知:
和水蒸气。已知:①
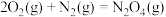
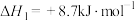
②
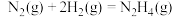
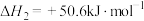
③
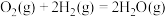
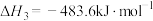
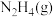 和
和 反应的热化学方程式为
反应的热化学方程式为(2)拆开1mol共价键所吸收的能量或形成1mol共价键所释放的能量称为键能。已知H-H键能为436
 ,H-N键能为391
,H-N键能为391 ,
, 键能为946
键能为946 。则工业合成氨的热化学方程式为
。则工业合成氨的热化学方程式为(3)
 溶液常用于腐蚀印刷电路铜板,发生
溶液常用于腐蚀印刷电路铜板,发生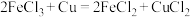 ,若将此反应设计成原电池,则负极所用电极材料为
,若将此反应设计成原电池,则负极所用电极材料为(4)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

①B为生物燃料电池的
②正极反应式为
③电池工作过程中,
 将移向
将移向④在电池反应中,每消耗1mol氧气,理论上生成标准状况下二氧化碳的体积是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】甲醇、二甲醚(CH3OCH3) 既是重要的化工原料,又是可再生能源,具有开发和应用广阔前景。
(1)合成二甲醚的反应原理为2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
①该反应能够自发进行的原因是_______ 。
②若容器的体积恒定不变,CO、H2起始通入量分别为2 mol、4 mol,充分反应后达到平衡。下列措施既可以提高反应速率又可以提高CO的转化率是_______ 。
a.升高温度 b.使用更高效的催化剂
c.充入He,使体系总压强增大 d.缩小体积增大压强
(2)工业上合成甲醇的化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH=-91 kJ·mol-1
CH3OH(g) ΔH=-91 kJ·mol-1
①已知某些化学键的键能数据如下表,则x=_______ 。
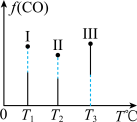
②在Ⅰ、Ⅱ、Ⅲ三个恒压容器中分别充入a mol CO和2a mol H2合成甲醇,三个容器的温度分别为T1、T2、T3。若实验测得反应均进行到t min时,三个容器中CO的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是_____ 。若反应达到平衡,三个容器中v(CH3OH)逆最大的是____ 。
(1)合成二甲醚的反应原理为2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。①该反应能够自发进行的原因是
②若容器的体积恒定不变,CO、H2起始通入量分别为2 mol、4 mol,充分反应后达到平衡。下列措施既可以提高反应速率又可以提高CO的转化率是
a.升高温度 b.使用更高效的催化剂
c.充入He,使体系总压强增大 d.缩小体积增大压强
(2)工业上合成甲醇的化学方程式为CO(g)+2H2(g)
 CH3OH(g) ΔH=-91 kJ·mol-1
CH3OH(g) ΔH=-91 kJ·mol-1①已知某些化学键的键能数据如下表,则x=
| 化学键 | C-H | H-H | C-O | C≡O | O-H |
| 键能/ kJ·mol-1 | a | b | c | x | d |

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol−1)。回答问题
(1)下列关于键能的叙述正确的是___________(填字母,下同)。
(2)已知热化学方程式:H2(g)+Cl2(g)=2HCl(g) ΔH=-183kJ·mol−1,则Cl2的键能为___________ kJ·mol−1。
(3)参考下表中的数据,判断下列分子受热时最稳定的是___________。
(4)能用键能大小解释的是___________。
| 化学键 | H-H | H-Cl |
| 键能 | 436 | 431 |
| A.每生成1molH-Cl吸收431.4kJ能量 |
| B.每生成1molH-Cl放出431.4kJ能量 |
| C.每拆开1molH-Cl放出431.4kJ能量 |
| D.每拆开1molH-Cl吸收431.4kJ能量 |
(3)参考下表中的数据,判断下列分子受热时最稳定的是___________。
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/(kJ·mol-1) | 436 | 565 | 431 | 368 |
| A.H2 | B.HF | C.HCl | D.HBr |
| A.常温常压下,溴呈液态,碘呈固态 | B.氮气的化学性质比氧气稳定 |
| C.稀有气体一般很难发生化学反应 | D.硝酸易挥发而硫酸难挥发 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________ 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g) CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl_______ P2;A、B、C三点处对应平衡常数(KA、KB、KC)的由大到小的顺序为__________ 。(填“<”、“>”“=”)
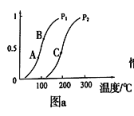
②100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则v(H2)=________________ 100℃时该反应的平衡常数K =_________ 。反应达到平衡的标志是:_____________ 。
A.容器内气体密度恒定
B.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C.容器的压强恒定
D.3v正(CH4)= v逆(H2)
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________ (填编号)。
A.升高温度 B.缩小容器体积 C.再充入CH4气体 D.使用合适的催化剂
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g)
 CO(g)+ 3H2(g)
CO(g)+ 3H2(g)①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl

②100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则v(H2)=
A.容器内气体密度恒定
B.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C.容器的压强恒定
D.3v正(CH4)= v逆(H2)
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有
A.升高温度 B.缩小容器体积 C.再充入CH4气体 D.使用合适的催化剂
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】已知下列热化学方程式,回答下列各问:
① C(s)+1/2O2(g)=CO(g) ΔH =—110.4 kJ/mol
② C(s)+ O2(g)=CO2(g) ΔH =—393.5 kJ/mol
(1)C的燃烧热为______ kJ/mol 。
(2)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧热的热化学方程式__________________________________________________ 。
(3)工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OCH3(g)+H2O(g) = 2CH3OH(g) ΔH2=+23.4 kJ·mol-1
则2CO2(g)+6H2(g) = CH3OCH3(g)+3H2O(g) ΔH3=________ kJ·mol-1。
(4)在恒温(500K)、体积为1.0L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 + 3H2 2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为
2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为___________________________________ 。
① C(s)+1/2O2(g)=CO(g) ΔH =—110.4 kJ/mol
② C(s)+ O2(g)=CO2(g) ΔH =—393.5 kJ/mol
(1)C的燃烧热为
(2)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧热的热化学方程式
(3)工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OCH3(g)+H2O(g) = 2CH3OH(g) ΔH2=+23.4 kJ·mol-1
则2CO2(g)+6H2(g) = CH3OCH3(g)+3H2O(g) ΔH3=
(4)在恒温(500K)、体积为1.0L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 + 3H2
 2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为
2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】北京2022年冬奥会期间,超1000辆氢能源汽车为冬奥会服务。氢能源作为绿色能源具有广阔的发展空间,但氢能源的来源成为制约其发展的一个瓶颈。回答下列问题:
(1)氢能源的工业生产来源之一是天然气,如甲烷的重整反应(重整反应时伴随积碳副反应):
①重整反应的焓变
_______ 。
②在恒压密闭容器中按投料比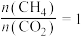 投料,在不同的温度下反应达到平衡时,各含碳组分的物质的量变化曲线如下图所示。
投料,在不同的温度下反应达到平衡时,各含碳组分的物质的量变化曲线如下图所示。
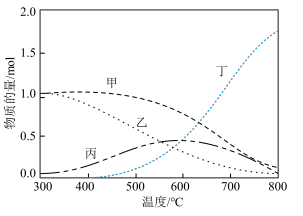
甲表示的物质是_______ (填化学式),温度低于400℃时积碳很少,但实际生产却采用高于400℃的温度,原因是_______ 。
(2)在恒温(T)、恒压( )密闭容器中,按投料比
)密闭容器中,按投料比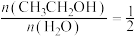 投料,发生反应:
投料,发生反应: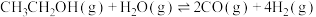
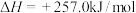 。达到平衡时,测得水的转化率为25%。则该温度下的压强平衡常数
。达到平衡时,测得水的转化率为25%。则该温度下的压强平衡常数
_______ ,乙醇的转化率为_______ 。
(3)利用天然气分解也可制备 ,反应如下:
,反应如下:
反应Ⅲ: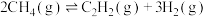

反应Ⅳ:

已知: 、
、 分别为正反应速率常数和逆反应速率常数,该常数只与温度、催化剂有关。
分别为正反应速率常数和逆反应速率常数,该常数只与温度、催化剂有关。
通过实验测得反应Ⅲ的正反应速率和逆反应速率方程: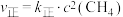 ,
,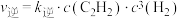 。一定温度时测得
。一定温度时测得 ,则该温度时的平衡常数
,则该温度时的平衡常数
_____ 。
(1)氢能源的工业生产来源之一是天然气,如甲烷的重整反应(重整反应时伴随积碳副反应):
| 重整反应 | 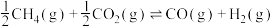  | |
| 积碳反应 | I | 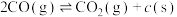 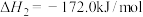 |
| II | 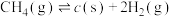 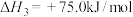 | |

②在恒压密闭容器中按投料比
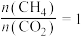 投料,在不同的温度下反应达到平衡时,各含碳组分的物质的量变化曲线如下图所示。
投料,在不同的温度下反应达到平衡时,各含碳组分的物质的量变化曲线如下图所示。
甲表示的物质是
(2)在恒温(T)、恒压(
 )密闭容器中,按投料比
)密闭容器中,按投料比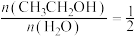 投料,发生反应:
投料,发生反应: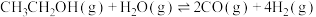
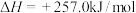 。达到平衡时,测得水的转化率为25%。则该温度下的压强平衡常数
。达到平衡时,测得水的转化率为25%。则该温度下的压强平衡常数
(3)利用天然气分解也可制备
 ,反应如下:
,反应如下:反应Ⅲ:
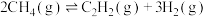

反应Ⅳ:


已知:
 、
、 分别为正反应速率常数和逆反应速率常数,该常数只与温度、催化剂有关。
分别为正反应速率常数和逆反应速率常数,该常数只与温度、催化剂有关。通过实验测得反应Ⅲ的正反应速率和逆反应速率方程:
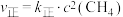 ,
,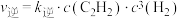 。一定温度时测得
。一定温度时测得 ,则该温度时的平衡常数
,则该温度时的平衡常数
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】汽车已成为现代社会的重要交通工具之一。它所使用燃料经历了从煤到汽油的变迁。时至今日,人们依然在探索、优化车用燃料。
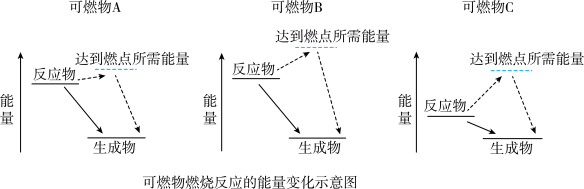
(1)某同学根据所查阅资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图(如图)。根据示意图,你认为哪种物质更适合用作车用燃料______ (填写字母);并说出你的选择依据______ 。
(2)庚烷(C7H16)是汽油的主要成分之一。完全燃烧1g庚烷生成二氧化碳气体和液态水时产生的热量为48kJ。请写出表示庚烷燃烧热的热化学方程式______ ;
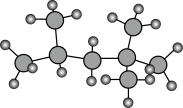
(3)目前汽车主要使用燃料为汽油。“辛烷值”用来表示汽油的质量。异辛烷用作抗爆性优良的标准,辛烷值为100。正庚烷用作抗爆性低劣的标准,辛烷值为0。如图是异辛烷的球棍模型:
①1mol异辛烷和1mol正庚烷分别完全燃烧生成水和二氧化碳,消耗氧气的质量之差是______ g。
②异辛烷的同分异构体有很多,其中一种同分异构体X,其一氯代物只有一种结构,则X的结构简式为______ 。
(4)车用燃料在使用过程中会产生汽车尾气(主要含有一氧化碳,一氧化氮),是造成空气污染的主要因素之一。可在汽车尾气系统中安装催化转化器,使CO和NO在催化剂的作用下反应生成两种无污染的气体。其中,氮气和氧气反应生成一氧化氮的能量变化如图所示,则由该反应生成2mol NO(g),对应热化学方程式的△H=______

(1)某同学根据所查阅资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图(如图)。根据示意图,你认为哪种物质更适合用作车用燃料

(2)庚烷(C7H16)是汽油的主要成分之一。完全燃烧1g庚烷生成二氧化碳气体和液态水时产生的热量为48kJ。请写出表示庚烷燃烧热的热化学方程式
(3)目前汽车主要使用燃料为汽油。“辛烷值”用来表示汽油的质量。异辛烷用作抗爆性优良的标准,辛烷值为100。正庚烷用作抗爆性低劣的标准,辛烷值为0。如图是异辛烷的球棍模型:

①1mol异辛烷和1mol正庚烷分别完全燃烧生成水和二氧化碳,消耗氧气的质量之差是
②异辛烷的同分异构体有很多,其中一种同分异构体X,其一氯代物只有一种结构,则X的结构简式为
(4)车用燃料在使用过程中会产生汽车尾气(主要含有一氧化碳,一氧化氮),是造成空气污染的主要因素之一。可在汽车尾气系统中安装催化转化器,使CO和NO在催化剂的作用下反应生成两种无污染的气体。其中,氮气和氧气反应生成一氧化氮的能量变化如图所示,则由该反应生成2mol NO(g),对应热化学方程式的△H=

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】依据事实,按要求填空:
(1)在25℃、101kPa下,1mol乙醇燃烧生成CO2和液态水时放热1269.6kJ.则表示乙醇燃烧热的热化学方程式为______ .
(2)已知拆开1mol H﹣H键,1molN﹣H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为______ .
(3)已知:2SO2(g)+O2(g)═2SO3(g)△H=﹣196.6kJ•mol﹣1
2NO(g)+O2(g)═2NO2(g)△H=﹣113.0kJ•mol﹣1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=______ kJ•mol﹣1.
(4)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:______ .
(1)在25℃、101kPa下,1mol乙醇燃烧生成CO2和液态水时放热1269.6kJ.则表示乙醇燃烧热的热化学方程式为
(2)已知拆开1mol H﹣H键,1molN﹣H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为
(3)已知:2SO2(g)+O2(g)═2SO3(g)△H=﹣196.6kJ•mol﹣1
2NO(g)+O2(g)═2NO2(g)△H=﹣113.0kJ•mol﹣1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=
(4)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】2021年6月17日,我国自主研制的神舟十二号载人飞船发射成功,并与空间站完成自主快速交会对接。时隔五年,神舟载人飞船再次将航天员送入太空。
(1)神舟系列火箭推进剂以前由液态肼(N2H4)和液态双氧水组成,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。
已知:0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出256kJ的热量。回答下列问题:
①该反应的热化学方程式为:_____ 。
②反应中的氧化剂是:_____ (写化学式)。
③当有1mol氮气生成时,反应转移的电子数为_____ NA。
(2)某型号的载人飞船用改进型“长征二号”F遥八火箭推进剂采用四氧化二氮和偏二甲肼(C2H8N2)作为推进剂,燃烧后生成的产物都是无毒无害的物质。请写出该推进剂在发动机中充分燃烧时发生反应的化学方程式:(偏二甲肼中C为-2价)_____ 。若有90g偏二甲肼完全反应,则生成的氧化产物分别是_____ 、_____ (填物质的化学式),他们的物质的量分别为_____ 、_____ (物质与物质的量需要对应)。
(1)神舟系列火箭推进剂以前由液态肼(N2H4)和液态双氧水组成,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。
已知:0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出256kJ的热量。回答下列问题:
①该反应的热化学方程式为:
②反应中的氧化剂是:
③当有1mol氮气生成时,反应转移的电子数为
(2)某型号的载人飞船用改进型“长征二号”F遥八火箭推进剂采用四氧化二氮和偏二甲肼(C2H8N2)作为推进剂,燃烧后生成的产物都是无毒无害的物质。请写出该推进剂在发动机中充分燃烧时发生反应的化学方程式:(偏二甲肼中C为-2价)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】工业上常用催化氧化的方法将尾气中的NH3转化为N2除去。涉及反应: 。
。
已知:部分化学键的键能如表
回答下列问题:
(1)NH3(g)中N—H键的键能为_____ 。
(2)反应 的
的
_____ 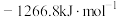 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(3)已知反应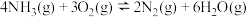 的能量变化如图甲所示。
的能量变化如图甲所示。

其中加入了催化剂的能量变化曲线为_____ (填“a”或“b”);若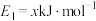 ,则
,则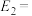
_____  (用含x的代数式表示)。
(用含x的代数式表示)。
(4)用水吸收NH3,并利用图乙装置,测定稀氨水与稀盐酸发生中和反应的反应热。

①仪器A的名称是_____ ,其作用为_____ ;隔热层的作用为_____ 。
②通过实验测定稀氨水与稀盐酸发生中和反应生成1molH2O(l)所释放的热量_____ 57.3kJ(填“>”“=”或“<”)。
③若实验过程中未加杯盖,求得稀氨水与稀盐酸发生中和反应生成1molH2O(l)的反应热 将
将_____ (填“偏大”“偏小”或“无影响”)。
 。
。已知:部分化学键的键能如表
| 化学键 |  |  |  |
键能/( ) ) | 946 | 498 | 464 |
(1)NH3(g)中N—H键的键能为
(2)反应
 的
的
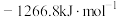 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(3)已知反应
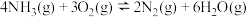 的能量变化如图甲所示。
的能量变化如图甲所示。
其中加入了催化剂的能量变化曲线为
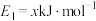 ,则
,则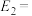
 (用含x的代数式表示)。
(用含x的代数式表示)。(4)用水吸收NH3,并利用图乙装置,测定稀氨水与稀盐酸发生中和反应的反应热。

①仪器A的名称是
②通过实验测定稀氨水与稀盐酸发生中和反应生成1molH2O(l)所释放的热量
③若实验过程中未加杯盖,求得稀氨水与稀盐酸发生中和反应生成1molH2O(l)的反应热
 将
将
您最近一年使用:0次
【推荐2】CH3OH是重要的基本有机原料,利用反应A可将CH4转化为CH3OH。
反应A:2CH4(g)+O2(g)=2CH3OH(g) ΔH<0
(1)已知:破坏1mol化学键所需要的能量如下表所示。
①CH4的电子式是_______ 。
②ΔH=_______ kJ·mol-1。
③CH4难溶于水,而CH3OH能与水任意比互溶,原因是_______ 。
(2)一定条件下将CH4与O2直接混合实现反应A,往往产生CO2等副产物。我国科研工作者利用FeCl3实现CH4的选择性氯化,使CH4转化为CH3Cl,并进一步水解得到CH3OH,流程示意如下。

①反应i的化学方程式是_______ 。
②物质b是_______ 。
③由FeCl3溶液结晶得到FeCl3·6H2O晶体,在HCl的气流中加热FeCl3·6H2O晶体,能得到无水FeCl3,实现物质的循环利用。结合平衡移动原理解释HCl的作用:_______ 。
反应A:2CH4(g)+O2(g)=2CH3OH(g) ΔH<0
(1)已知:破坏1mol化学键所需要的能量如下表所示。
| 化学键 | C—H | O=O | O—H | C—O |
| 能量/kJ | a | b | c | d |
②ΔH=
③CH4难溶于水,而CH3OH能与水任意比互溶,原因是
(2)一定条件下将CH4与O2直接混合实现反应A,往往产生CO2等副产物。我国科研工作者利用FeCl3实现CH4的选择性氯化,使CH4转化为CH3Cl,并进一步水解得到CH3OH,流程示意如下。

①反应i的化学方程式是
②物质b是
③由FeCl3溶液结晶得到FeCl3·6H2O晶体,在HCl的气流中加热FeCl3·6H2O晶体,能得到无水FeCl3,实现物质的循环利用。结合平衡移动原理解释HCl的作用:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】(1)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
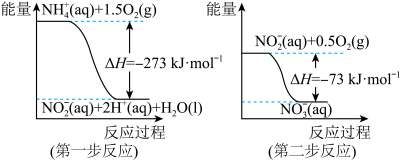
①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是_______ 。
②1mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_________________________ 。
(2) 已知红磷比白磷稳定,则反应:
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1_____ ΔH2(填“>”“<”或“=”)。
(3) 已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ•mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ•mol-1 ②
O2(g) ΔH=-226 kJ•mol-1 ②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为__________________ 。
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ•mol-1,蒸发1mol Br2(l)需要吸收的能量为30kJ,其他相关数据如下表:
则表中a=__________________ 。
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②1mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(2) 已知红磷比白磷稳定,则反应:
P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
ΔH1和ΔH2的关系是ΔH1
(3) 已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ•mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g) ΔH=-226 kJ•mol-1 ②
O2(g) ΔH=-226 kJ•mol-1 ②则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ•mol-1,蒸发1mol Br2(l)需要吸收的能量为30kJ,其他相关数据如下表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
您最近一年使用:0次



