有X、Y、Z、W四种短周期元素,原子序数依次增大。X的阳离子就是一个质子。Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层电子数的2倍。请回答:
(1)Z2的电子式为_________ ,Y的原子结构示意图为________ ,YW2的结构式为________ 。
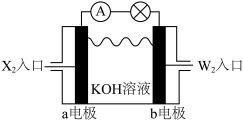
(2)将X2、W2 按下图所示通入某燃料电池中,其中,b电极的电极反应式为________ 。若有16gW2参加反应,转移的电子数是_______ NA。
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为______________________________________________
(1)Z2的电子式为
(2)将X2、W2 按下图所示通入某燃料电池中,其中,b电极的电极反应式为

(3)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为
更新时间:2017-12-22 15:17:23
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】附加题:铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,则 PbO2的酸性比CO2的酸性________ (填强或弱)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为_____________________ 。
(3)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H= a kJ·mol-1
②PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H= b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H= c kJ·mol-1
反应3PbS(s)+ 6O2(g)=3PbSO4(s) ΔH=_____________ kJ ·mol-1(用含a,b ,c的代数式表示)。
(4)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为___________________________________ 。

(5)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(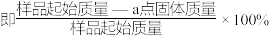 )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x=
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x=________ 和m:n=__________ 。

(1)铅是碳的同族元素,比碳多4个电子层,则 PbO2的酸性比CO2的酸性
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为
(3)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H= a kJ·mol-1
②PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H= b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H= c kJ·mol-1
反应3PbS(s)+ 6O2(g)=3PbSO4(s) ΔH=
(4)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为

(5)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(
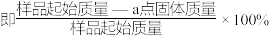 )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x=
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x=
您最近一年使用:0次
【推荐2】2022年北京冬奥会开幕式于2022年2月4日在国家体育场鸟巢隆重举行,其中奥运圣火的燃料为氢燃料,具有热值高、耐寒、环保无污染等优点。工业上可以通过催化重整二氧化碳和水蒸气制氢,主要有如下三个反应:
I.CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH1=+206 kJ·mol-1;
II.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41 kJ·mol-1;
III.CO2(g)+CH4(g)2 ⇌CO(g)+2H2(g) ΔH3。
回答下列问题:
(1)反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g) ΔH3=_______ 。
(2)将1 mol CH4(g)与3 mol H2O(g)充入初始体积为1 L的恒压反应容器中,平衡时,各含碳物质的物质的量分数与温度之间的变化关系如图所示。

①曲线a代表的物质为_______ (填化学式。下同);曲线c代表的物质为_______ 。
②450℃至580℃,曲线b代表物质的物质的量分数先随温度升高而增大的主要原因是_______ 。
③450℃时,反应进行2 min后,甲烷的物质的量浓度为0.8 mol·L-1,2 min内CH4(g)表示的化学反应速率为_______ mol·L-1·min-1;平衡时,容器中气体总物质的量为nmol,容器体积为V L,则反应I的平衡常数K1=_______ (通过反应I、II计算即可,反应II不影响计算结果,用含有n、V的代数式表示,不需要化简)。
(3)我国科学家在《Science》杂志发表了利用H2制取H2O2的绿色方法,原理如图所示(电极a、b均为覆盖催化剂的多孔惰性电极)。

①X膜为_______ (填“阳”或“阴”)离子交换膜。
②电池的总反应方程式为_______ ;每制取17 g溶质质量分数为30%的H2O2溶液,导线中转移_______ mol e-。
I.CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH1=+206 kJ·mol-1;
II.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41 kJ·mol-1;
III.CO2(g)+CH4(g)2 ⇌CO(g)+2H2(g) ΔH3。
回答下列问题:
(1)反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g) ΔH3=
(2)将1 mol CH4(g)与3 mol H2O(g)充入初始体积为1 L的恒压反应容器中,平衡时,各含碳物质的物质的量分数与温度之间的变化关系如图所示。

①曲线a代表的物质为
②450℃至580℃,曲线b代表物质的物质的量分数先随温度升高而增大的主要原因是
③450℃时,反应进行2 min后,甲烷的物质的量浓度为0.8 mol·L-1,2 min内CH4(g)表示的化学反应速率为
(3)我国科学家在《Science》杂志发表了利用H2制取H2O2的绿色方法,原理如图所示(电极a、b均为覆盖催化剂的多孔惰性电极)。

①X膜为
②电池的总反应方程式为
您最近一年使用:0次
【推荐3】在容积固定的VL密闭容器中充入4molNH3和5molO2,发生如下反应:4NH3(g)+5O2(g)  4NO(g)+6H2O(g)。请回答下列问题:
4NO(g)+6H2O(g)。请回答下列问题:
(1)下列能说明该反应已经达到平衡状态的是_______ ;
A .容器中气体总质量不变
B. c(O2)不变
C. υ(O2)=1.25υ(NH3)
D. 体系压强不变
E. 相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)已知上述反应达到平衡后,该反应各物质的浓度的定量关系称之为K,其表达式可表示为K = 。如果达到平衡时,NH3的转化率为a,则K=
。如果达到平衡时,NH3的转化率为a,则K=_____ (用含a的式子表示,数字采用指数形式)。
(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小。则速率逐渐增大是因为______ ,速率又逐渐减小的原因是_____ 。
(4)1mol NH3(g)在纯氧中完全燃烧生成无污染的气态物质,放出akJ的热量。写出该反应的热化学方程式_____ 。
(5)若将(4)所述反应设计为原电池,负极反应式______ 。
 4NO(g)+6H2O(g)。请回答下列问题:
4NO(g)+6H2O(g)。请回答下列问题:(1)下列能说明该反应已经达到平衡状态的是
A .容器中气体总质量不变
B. c(O2)不变
C. υ(O2)=1.25υ(NH3)
D. 体系压强不变
E. 相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)已知上述反应达到平衡后,该反应各物质的浓度的定量关系称之为K,其表达式可表示为K =
 。如果达到平衡时,NH3的转化率为a,则K=
。如果达到平衡时,NH3的转化率为a,则K=(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小。则速率逐渐增大是因为
(4)1mol NH3(g)在纯氧中完全燃烧生成无污染的气态物质,放出akJ的热量。写出该反应的热化学方程式
(5)若将(4)所述反应设计为原电池,负极反应式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】如图是元素周期表的一部分,按要求回答问题:
(1)元素④在周期表中位置是_______ ,原子结构示意图_______ 。元素③的最高价氧化物的化学式为_______ ,具有强_______ (氧化/还原)性。
(2)元素④⑤组成化合物电子式分别为_______ ,_______ 。
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为_______ 。
(4)元素④⑤⑥⑧形成的简单原子,其原子半径由小到大的顺序为_______ (用原子符号表示)。
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)元素④⑤组成化合物电子式分别为
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为
(4)元素④⑤⑥⑧形成的简单原子,其原子半径由小到大的顺序为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】已知T、X、Y、Z是四种常见的短周期元素,其结构或性质信息如下表。请填空:

(1)写出与Y2互为等电子体的物质的分子式_______________ 。
(2)写出Y的最简单气态氢化物的结构式_______________ 。
(3)元素Q的原子序数比X与Z的原子序数之和还多1。
①该元素基态原子的价电子排布式为____________________________ 。
②向含Q离子的水溶液中逐滴加入Y的简单氢化物的水溶液至过量,写出有关反应的离子方程式____________________ 、_____________________ 。

(1)写出与Y2互为等电子体的物质的分子式
(2)写出Y的最简单气态氢化物的结构式
(3)元素Q的原子序数比X与Z的原子序数之和还多1。
①该元素基态原子的价电子排布式为
②向含Q离子的水溶液中逐滴加入Y的简单氢化物的水溶液至过量,写出有关反应的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D,B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C属于同一周期,两者可以形成许多种共价化合物,C、F属于同一主族,B原子最外电子层的p能级上的电子处于半充满状态,C的最外层电子数是内层电子数的3倍,E的最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素基态原子电子排布式为__ 。
(2)F元素基态原子的价电子轨道表示式为__ 。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为__ 。
(4)A、C形成的两种常见分子中,其中一种为绿色氧化剂,电子式为__ 。
(5)基态G原子中,电子占据的最高电子层符号是__ ,该电子层有__ 个能级,电子数是__ 。该原子有__ 种运动状态不同的电子,最高能级符号是__ ,未成对电子数为__ 。
(6)与E同族且有4个电子层的元素的符号为__ ,它的简化电子排布式为__ ,与该元素同周期且核电荷数比该元素小7的元素在周期表中的位置是__ ,该元素基态原子的价电子排布式为__ ,__ (填“满足”或“不满足”)构造原理。
(1)E元素基态原子电子排布式为
(2)F元素基态原子的价电子轨道表示式为
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为
(4)A、C形成的两种常见分子中,其中一种为绿色氧化剂,电子式为
(5)基态G原子中,电子占据的最高电子层符号是
(6)与E同族且有4个电子层的元素的符号为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】现有部分元素的性质与原子(或分子)结构如下表:
(1)写出元素T的原子结构示意图_____________ ;X元素的气态氢化物与其最高价含氧酸反应的离子方程式为______________ ;
(2)元素Y与元素Z相比,金属性较强的是________ (用元素符号表示),下列表述中能证明这一事实的是__________ (填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(2)元素Y与元素Z相比,金属性较强的是
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】已知 、
、 、
、 、
、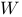 是短周期界元素中的四种非金属元素,它们的原子序数依次增大,
是短周期界元素中的四种非金属元素,它们的原子序数依次增大, 元素的原子形成的离子就是一个质子,
元素的原子形成的离子就是一个质子,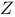 、
、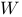 在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,
在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体, 原子的最外层电子数是内层电子数的2倍。
原子的最外层电子数是内层电子数的2倍。
1.请写出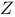 在元素周期表中的位置为第
在元素周期表中的位置为第________ 周期、第________ 族。
2.气体分子 的电子式为
的电子式为________________
3.由 、
、 、
、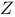 、
、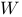 四种元素可组成酸式盐,该化合物的水溶液与足量
四种元素可组成酸式盐,该化合物的水溶液与足量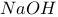 溶液在加热条件下反应的离子方程式为
溶液在加热条件下反应的离子方程式为_________________ 。
4.在一定条件下,由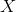 单质与单质可化合生成
单质与单质可化合生成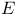 ,工业上用
,工业上用
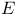 检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质
检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质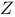 生成,写出化学方程式
生成,写出化学方程式__________________________________ 。该反应中被氧化的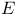 与参与反应的
与参与反应的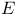 的质量之比
的质量之比____________ 。
 、
、 、
、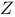 、
、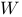 是短周期界元素中的四种非金属元素,它们的原子序数依次增大,
是短周期界元素中的四种非金属元素,它们的原子序数依次增大, 元素的原子形成的离子就是一个质子,
元素的原子形成的离子就是一个质子,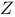 、
、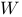 在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,
在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体, 原子的最外层电子数是内层电子数的2倍。
原子的最外层电子数是内层电子数的2倍。1.请写出
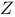 在元素周期表中的位置为第
在元素周期表中的位置为第2.气体分子
 的电子式为
的电子式为3.由
 、
、 、
、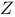 、
、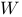 四种元素可组成酸式盐,该化合物的水溶液与足量
四种元素可组成酸式盐,该化合物的水溶液与足量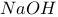 溶液在加热条件下反应的离子方程式为
溶液在加热条件下反应的离子方程式为4.在一定条件下,由
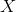 单质与单质可化合生成
单质与单质可化合生成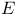 ,工业上用
,工业上用
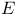 检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质
检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质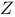 生成,写出化学方程式
生成,写出化学方程式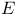 与参与反应的
与参与反应的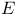 的质量之比
的质量之比
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】I.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y原子的最外层电子数是电子层数的2倍,Z是地壳中含量最高的非金属元素,Q元素形成的单质是重要的半导体材料,R元素原子核外的M电子层电子数比L层少2个。请回答下列问题:
(1)画出Z的原子结构示意图__________ ,其氢化物的电子式__________ 。
(2) 、Z、Q三种元素的原子半径由大到小的顺序
、Z、Q三种元素的原子半径由大到小的顺序__________  用元素符号表示
用元素符号表示 。
。
(3)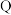 元素在周期表中的位置
元素在周期表中的位置_________ ,与Q同主族第四周期的元素的原子序数是_____ ,在周期表的以下区域中,可以找到类似的半导体材料的是__________  填字母序号
填字母序号 。
。
a.过渡元素区域
b.金属和非金属元素的分界线附近
c.含有氟、氯、硫、磷等元素的区域
 下列能说明Y与R元素非金属性相对强弱的是
下列能说明Y与R元素非金属性相对强弱的是__________ 。
a.单质与氢气化合的难易程度
b.含氧酸的酸性:
c.Y与R相互形成的化合物中元素的化合价
Ⅱ 已知:
已知:

合成氨的热化学方程式是___________________________________ 。
Ⅲ 有人设想以
有人设想以 和
和 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________ 。

(1)画出Z的原子结构示意图
(2)
 、Z、Q三种元素的原子半径由大到小的顺序
、Z、Q三种元素的原子半径由大到小的顺序 用元素符号表示
用元素符号表示 。
。(3)
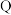 元素在周期表中的位置
元素在周期表中的位置 填字母序号
填字母序号 。
。a.过渡元素区域
b.金属和非金属元素的分界线附近
c.含有氟、氯、硫、磷等元素的区域
 下列能说明Y与R元素非金属性相对强弱的是
下列能说明Y与R元素非金属性相对强弱的是a.单质与氢气化合的难易程度
b.含氧酸的酸性:

c.Y与R相互形成的化合物中元素的化合价
Ⅱ
 已知:
已知:
合成氨的热化学方程式是
Ⅲ
 有人设想以
有人设想以 和
和 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为
您最近一年使用:0次



