用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量10.0 g 含有少量易溶杂质的样品(杂质不与盐酸反应),配成500mL待测溶液。称量时,样品可放在________ (填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol/L的盐酸来滴定待测溶液,不 可选用________ (填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视________________________________________________ ;在铁架台上垫一张白纸,其目的是__________________________________________ 。
(4)根据下表中数据,计算被测烧碱溶液的物质的量浓度是________ mol/L,烧碱样品的纯度是________ 。
(5)在中和滴定操作过程中,有以下各项因操作不当引起的实验误差,用“偏高”、“偏低”或“无影响”等填空:
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果__________ 。
②锥形瓶未用待装溶液润洗,使滴定结果__________ 。
③装标准溶液的滴定管在滴定前尖嘴处有气泡,滴定终了无气泡,使滴定结果__________ 。
④滴定前平视凹液面,滴定终了俯视凹液面,使滴定结果___________________ 。
(1)准确称量10.0 g 含有少量易溶杂质的样品(杂质不与盐酸反应),配成500mL待测溶液。称量时,样品可放在
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol/L的盐酸来滴定待测溶液,
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视
(4)根据下表中数据,计算被测烧碱溶液的物质的量浓度是
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果
②锥形瓶未用待装溶液润洗,使滴定结果
③装标准溶液的滴定管在滴定前尖嘴处有气泡,滴定终了无气泡,使滴定结果
④滴定前平视凹液面,滴定终了俯视凹液面,使滴定结果
更新时间:2018-01-20 10:44:42
|
【知识点】 酸碱中和滴定的综合考查解读
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
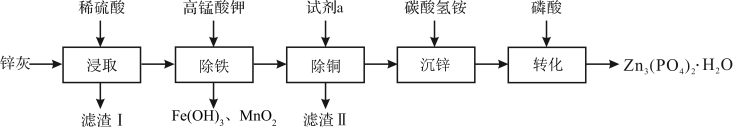
【推荐1】四水合磷酸锌 [Zn3(PO4)2·4H2O,摩尔质量为457 g·mol-1,难溶于水] 是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如图,回答下列问题:
已知:①6NH4HCO3 + 3ZnSO4 ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
②ZnCO3·2Zn(OH)2·H2O + 2H3PO4 Zn3(PO4)2·4H2O + 2H2O + CO2↑
Zn3(PO4)2·4H2O + 2H2O + CO2↑
③常温下,Fe3+、Fe2+、Cu2+、Zn2+生成氢氧化物沉淀时的pH:
(1)滤渣Ⅰ的主要成分为_______ ;试剂a为_______ ;
(2)“除铁”操作时,需先将溶液调至接近中性,然后再滴加KMnO4溶液,使溶液中的铁元素转化为Fe(OH)3,该反应的离子方程式为_______ ;
(3)“转化”结束后,从混合液中分离得到Zn3(PO4)2·4H2O的操作包括_______ 和干燥。
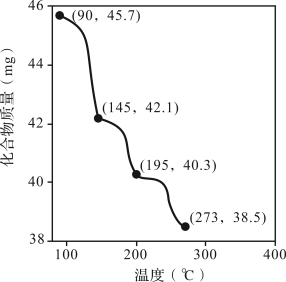
(4)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为_______。
(5)为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验:(已知:Zn2+与H2Y2−按1:1反应;杂质不反应。)
步骤Ⅰ:准确称取0.4570g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH = 5~6的缓冲溶液中用0.02000mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为_______ ;产品中Zn3(PO4)2·4H2O的质量分数为_______ 。下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是_______ 。
a.步骤I中定容时俯视刻度线
b.步骤I中转移溶液时未洗涤烧杯
c.步骤II中滴定管未用Na2H2Y标准溶液润洗
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡

已知:①6NH4HCO3 + 3ZnSO4
 ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑②ZnCO3·2Zn(OH)2·H2O + 2H3PO4
 Zn3(PO4)2·4H2O + 2H2O + CO2↑
Zn3(PO4)2·4H2O + 2H2O + CO2↑③常温下,Fe3+、Fe2+、Cu2+、Zn2+生成氢氧化物沉淀时的pH:
| Fe3+ | Fe2+ | Cu2+ | Zn2+ | |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 | 5.7 |
| 完全沉淀时的pH | 3.7 | 9.0 | 6.7 | 8.1 |
(2)“除铁”操作时,需先将溶液调至接近中性,然后再滴加KMnO4溶液,使溶液中的铁元素转化为Fe(OH)3,该反应的离子方程式为
(3)“转化”结束后,从混合液中分离得到Zn3(PO4)2·4H2O的操作包括
(4)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为_______。

| A.90~145℃ | B.145~195℃ | C.195~273℃ | D.>273℃ |
步骤Ⅰ:准确称取0.4570g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH = 5~6的缓冲溶液中用0.02000mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为
a.步骤I中定容时俯视刻度线
b.步骤I中转移溶液时未洗涤烧杯
c.步骤II中滴定管未用Na2H2Y标准溶液润洗
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某化学实验小组想要了解市场上所售食用白醋 主要是醋酸的水溶液
主要是醋酸的水溶液 的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
(1)反应生成的CH3COONa溶液显_________ 性,用离子方程式解释原因:____________ ,则实验中应选用上表中的__________ 作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:_________________ 。
(3)第一次滴定前后,碱式滴定管中的液面位置如下图所示,请将有关数据填入下面表格的空白处。

滴定前_____________ ,滴定后____________ ,溶液体积________________
(4)从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显多于其余两次,其原因可能是________ 。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第二次滴定用的锥形瓶用待装液润洗过
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,计算该白醋中醋酸的物质的量浓度:c=______________ 。
 主要是醋酸的水溶液
主要是醋酸的水溶液 的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:
(3)第一次滴定前后,碱式滴定管中的液面位置如下图所示,请将有关数据填入下面表格的空白处。

| 滴定次数 | 待食用白醋的体积/mL | 0.1000mol/L NaOH溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | ______ | ______ | _____ |
| 第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(4)从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显多于其余两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第二次滴定用的锥形瓶用待装液润洗过
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,计算该白醋中醋酸的物质的量浓度:c=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】I 充满HCl(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以确定该稀盐酸的准确物质的量浓度。回答下列问题:
(1)该滴定实验盛装标准液的仪器是__________ , 若该仪器的量程为50mL,调液面为0,将该仪器中所有液体放出,则放出的溶液体积_______ 50mL。(填“>”,“=”,“<”)
(2)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第______ 种。
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(3)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
求测得的稀盐酸的物质的量浓度为_________________________ 。
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________________________________ 。
(2)判断滴定终点的方法是_________________________________________________ 。
(3)计算:血液中含钙离子的浓度为____ g·mL-1。
(1)该滴定实验盛装标准液的仪器是
(2)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(3)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
| 实验编号 | 待测盐酸的体积(mL) | 滴入氢氧化钠溶液的体积(mL) |
| 1 | 20.00 | 17.30 |
| 2 | 20.00 | 17.02 |
| 3 | 20.00 | 16.98 |
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式
(2)判断滴定终点的方法是
(3)计算:血液中含钙离子的浓度为
您最近一年使用:0次



