水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子:NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:
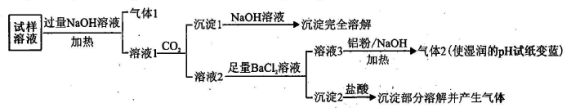
已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1”的电子式为_________ 。
(2)生成“沉淀1”的离子方程式为________ 。
(3)“沉淀2”的成分是___________ (填化学式)。
(4)“溶液3→气体2”的离子方程式为_________ 。
(5)根据上述实验可推断该地区大气颗粒物中_________ 含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的污染主体如下表:
根据实验结果可判断该地区大气颗粒物污染主体有___________ 。

已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1”的电子式为
(2)生成“沉淀1”的离子方程式为
(3)“沉淀2”的成分是
(4)“溶液3→气体2”的离子方程式为
(5)根据上述实验可推断该地区大气颗粒物中
(6)已知大气颗粒物中各元素的污染主体如下表:
| 元素 | N | S | Na、Mg、Cl | Al | Ca |
| 污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
18-19高三上·福建厦门·期末 查看更多[6]
福建省厦门市2018届高三上学期期末质检化学试题辽宁省大石桥2018届高三上学期期末质检化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题18 以离子性质为基础的无机推断题【全国百强校】福建省厦门外国语学校2019届高三上学期第一次月考化学试题【全国百强校】江西省新余市第四中学2019届高三上学期10月月考化学试题【全国百强校】内蒙古自治区赤峰市第二中学2019届高三上学期第三次月考化学试题
更新时间:2018-01-20 17:25:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e—结构。写出其电子式_____________________ 。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为______________ 。
(2)已知:2CO2(g) + 3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4a kJ/mol
CO2(g) +2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=-b kJ/mol
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________ 。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g) N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______ 。
②该反应的△H______ 0(填“>”或“<”)。
③甲、丙容器达到平衡时,CO的转化率为α(甲)________ α(乙)(填“>”,“< ”,“=”)
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42—+H2O NH3·H2O+HC2O4—的平衡常数K=
NH3·H2O+HC2O4—的平衡常数K=___ 。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e—结构。写出其电子式
(2)已知:2CO2(g) + 3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4a kJ/mol
CO2(g) +2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=-b kJ/mol
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)
 N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:| t/min | 0 | 40 | 80 | 120 | 160 |
| n(CO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(CO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
| n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
②该反应的△H
③甲、丙容器达到平衡时,CO的转化率为α(甲)
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42—+H2O
 NH3·H2O+HC2O4—的平衡常数K=
NH3·H2O+HC2O4—的平衡常数K=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】钴酸锂一般用作锂离子电池的正极材料,需求量大,而我国极度缺乏钴资源,主要依赖进口,因而从废旧电池中进行回收具有重要意义。以废旧钴酸锂电池材料(主要成分为LiCoO2,含单质Cu及为改善电池性能添加的单质Al等)回收钴酸锂的--种工艺流程如下:

回答下列问题:
(1)废旧钴酸锂电池需经放电、拆解、粉碎预处理,粉碎的目的是_____ 。
(2)“碱浸”所得滤液中主要溶质的化学式为__________ 、NaOH。
(3)H2O2的电子式为________ 。“酸浸”时H2O2作还原剂,还原产物为Co2+,反应的离子方程式为_________ ;上述反应的氧化产物又将铜氧化而溶解浸出,该反应的化学方程式为____________ 。
(4)“萃取铜”中的有机萃取剂用HR表示,发生萃取的反应可表示为Cu2+ +2HR CuR2++.2H+。若酸浸后的浸取液pH=1.000,c(Cu2+ ) =0.01001mol·L-1,多次萃取后水相中c(H+)为0.1200mol·L-1,则铜的萃取率为
CuR2++.2H+。若酸浸后的浸取液pH=1.000,c(Cu2+ ) =0.01001mol·L-1,多次萃取后水相中c(H+)为0.1200mol·L-1,则铜的萃取率为___________ (溶液体积变化忽略,保留小数点后两位);为回收铜,可用一定浓度的H2SO4将有机相中的铜反萃取到水相,其原理是______________________
(5)“碱浸”时少量未浸出的残余铝可在“酸浸”时浸出,萃取铜后的溶液需调pH至5.0以上将铝离子沉淀除去。若c(Co2+ ) =0.16mol·L-1,为避免析出Co(OH)2沉淀,则调pH不能超过___________ 。(已知K[Co(OH)2]=1.6×10-15)
(6)“钴、锂共沉淀”时析出CoCO3和li2CO3,经过滤、无水乙醇洗涤、80°C干燥后在750°C煅烧,反应的化学方程式为_________________ 。

回答下列问题:
(1)废旧钴酸锂电池需经放电、拆解、粉碎预处理,粉碎的目的是
(2)“碱浸”所得滤液中主要溶质的化学式为
(3)H2O2的电子式为
(4)“萃取铜”中的有机萃取剂用HR表示,发生萃取的反应可表示为Cu2+ +2HR
 CuR2++.2H+。若酸浸后的浸取液pH=1.000,c(Cu2+ ) =0.01001mol·L-1,多次萃取后水相中c(H+)为0.1200mol·L-1,则铜的萃取率为
CuR2++.2H+。若酸浸后的浸取液pH=1.000,c(Cu2+ ) =0.01001mol·L-1,多次萃取后水相中c(H+)为0.1200mol·L-1,则铜的萃取率为(5)“碱浸”时少量未浸出的残余铝可在“酸浸”时浸出,萃取铜后的溶液需调pH至5.0以上将铝离子沉淀除去。若c(Co2+ ) =0.16mol·L-1,为避免析出Co(OH)2沉淀,则调pH不能超过
(6)“钴、锂共沉淀”时析出CoCO3和li2CO3,经过滤、无水乙醇洗涤、80°C干燥后在750°C煅烧,反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】有A、B、C三种元素,已知5.75 g A单质跟盐酸完全反应,在标准状况下产生2.8L氢气和 0.25 mol ACln;B的气态氢化物的分子式为 H2B,其相对分子质量与B的最高价氧化物的水化物相对分子质量之比为1: 2.88,B原子核内质子数与中子数相等;C和B可形成液态化合物 CB2,并能溶解B的单质。试回答下列问题:
(1)A、B、C的名称分别是______ 、______ 、________ ;
(2) A离子的结构示意图为_______ ; B在周期表中的位置为_______ ;CB2的分子式为_______ 。
(3)A与B形成的化合物的化学式为_________
(4)B的最高价氧化物的水化物的化学式为_________ ,
(5)写出B的气态氢化物与B的低价氧化物反应生成淡黄色固体的化学方程式:__________________
(1)A、B、C的名称分别是
(2) A离子的结构示意图为
(3)A与B形成的化合物的化学式为
(4)B的最高价氧化物的水化物的化学式为
(5)写出B的气态氢化物与B的低价氧化物反应生成淡黄色固体的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】(1)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生如下离子反应:Mn2++S2O +H2O→MnO
+H2O→MnO +SO
+SO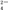 +H+(未配平)。
+H+(未配平)。
①该反应常用于检验Mn2+的存在,其特征现象是___________________________ 。
②若反应中有0.1 mol还原剂参加反应,则转移电子数为________ NA,消耗氧化剂的物质的量为________ mol。
(2)①向CuSO4溶液中通入硫化氢生成黑色沉淀CuS的离子方程式为___________________ 。
②向FeCl3溶液中加入过量的碘化钠的离子方程式为_______________________ 。
(3)向含有等物质的量浓度的H+、Mg2+、Al3+、NH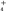 混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应。其中:第一个离子反应方程式为
混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应。其中:第一个离子反应方程式为__________________________ 。最后一个离子反应方程式为___________________________________________ 。
 +H2O→MnO
+H2O→MnO +SO
+SO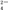 +H+(未配平)。
+H+(未配平)。①该反应常用于检验Mn2+的存在,其特征现象是
②若反应中有0.1 mol还原剂参加反应,则转移电子数为
(2)①向CuSO4溶液中通入硫化氢生成黑色沉淀CuS的离子方程式为
②向FeCl3溶液中加入过量的碘化钠的离子方程式为
(3)向含有等物质的量浓度的H+、Mg2+、Al3+、NH
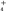 混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应。其中:第一个离子反应方程式为
混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应。其中:第一个离子反应方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】I、A、B、C、D四种可溶性盐,其阳离子分别是Na+、Ba2+、Cu2+、Ag+ 中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3- 中的某一种。现做以下实验:
①将四种盐各取少量,分别溶于盛有5 mL蒸馏水的四支试管中,只有B盐溶液呈蓝色。
②分别向4支试管中加入2 mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式:A___________ ,D__________ ;
(2)写出实验步骤②中产生较多气泡现象的离子反应方程式:_____________________________ 。
II、用98%的浓硫酸(其密度为1.84 g/cm3) 配制100 mL 1.0 mol·L-1稀硫酸
实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③溶解;④ 检漏、转移、洗涤;⑤定容、摇匀
若实验仪器有:
A .100 mL量筒 B.玻璃棒 C.50 mL容量瓶 D.100 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯
回答下列问题:
(1)需量取浓硫酸的体积为__________ mL。
(2)实验时不需选用的仪器有(填序号)_______________ 。
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)_______________ 。
① 定容时俯视刻度线观察液面 ② 容量瓶使用时未干燥
③ 定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④ 所用的浓硫酸长时间放置在密封不好的容器中
⑤ 用量筒量取浓硫酸时仰视读数
(4)检验试剂瓶中的溶液含有SO42-的操作是___________________________________ 。
①将四种盐各取少量,分别溶于盛有5 mL蒸馏水的四支试管中,只有B盐溶液呈蓝色。
②分别向4支试管中加入2 mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式:A
(2)写出实验步骤②中产生较多气泡现象的离子反应方程式:
II、用98%的浓硫酸(其密度为1.84 g/cm3) 配制100 mL 1.0 mol·L-1稀硫酸
实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③溶解;④ 检漏、转移、洗涤;⑤定容、摇匀
若实验仪器有:
A .100 mL量筒 B.玻璃棒 C.50 mL容量瓶 D.100 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯
回答下列问题:
(1)需量取浓硫酸的体积为
(2)实验时不需选用的仪器有(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
① 定容时俯视刻度线观察液面 ② 容量瓶使用时未干燥
③ 定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④ 所用的浓硫酸长时间放置在密封不好的容器中
⑤ 用量筒量取浓硫酸时仰视读数
(4)检验试剂瓶中的溶液含有SO42-的操作是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-、Br-中的几种。①若加入铝粉,产生的气体是H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则:

(1)溶液中的阳离子一定含有__________ ,阴离子无法确定是否存在的是___________ 。
(2)O→A、C→D的离子方程式为:
O→A____________________________________ 。
C→D______________________________________ 。
(3)为确定上述阴离子是否含有,只需向原溶液中加入某试剂,并测定产生的沉淀质量即可。下列试剂符合要求的是_______ 。
A.AlCl3 B.NaOH C.Ba(OH)2 D.BaCl2
若加入足量上述所选试剂后,产生沉淀质量为46.6克,则上述溶液中所有的阴离子及其物质的量为:____________ 、_______________ (没有就不填)。

(1)溶液中的阳离子一定含有
(2)O→A、C→D的离子方程式为:
O→A
C→D
(3)为确定上述阴离子是否含有,只需向原溶液中加入某试剂,并测定产生的沉淀质量即可。下列试剂符合要求的是
A.AlCl3 B.NaOH C.Ba(OH)2 D.BaCl2
若加入足量上述所选试剂后,产生沉淀质量为46.6克,则上述溶液中所有的阴离子及其物质的量为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
真题
解题方法
【推荐1】 是制造钒铁合金、金属钒的原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石煤中提取
是制造钒铁合金、金属钒的原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石煤中提取 的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下。
的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下。 的矿物,杂质为大量
的矿物,杂质为大量 和少量
和少量 等;苛化泥的主要成分为
等;苛化泥的主要成分为 等。
等。
ⅱ高温下,苛化泥的主要成分可与 反应生成偏铝酸盐;室温下,偏钒酸钙
反应生成偏铝酸盐;室温下,偏钒酸钙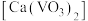 和偏铝酸钙均难溶于水。回答下列问题:
和偏铝酸钙均难溶于水。回答下列问题:
(1)钒原子的价层电子排布式为_______ ;焙烧生成的偏钒酸盐中钒的化合价为_______ ,产生的气体①为_______ (填化学式)。
(2)水浸工序得到滤渣①和滤液,滤渣①中含钒成分为偏钒酸钙,滤液中杂质的主要成分为_______ (填化学式)。
(3)在弱碱性环境下,偏钒酸钙经盐浸生成碳酸钙发生反应的离子方程式为_______ ; 加压导入盐浸工序可提高浸出率的原因为
加压导入盐浸工序可提高浸出率的原因为_______ ;浸取后低浓度的滤液①进入_______ (填工序名称),可实现钒元素的充分利用。
(4)洗脱工序中洗脱液的主要成分为_______ (填化学式)。
(5)下列不利于沉钒过程的两种操作为_______ (填序号)。
a.延长沉钒时间 b.将溶液调至碱性 c.搅拌 d.降低 溶液的浓度
溶液的浓度
 是制造钒铁合金、金属钒的原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石煤中提取
是制造钒铁合金、金属钒的原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石煤中提取 的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下。
的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下。
 的矿物,杂质为大量
的矿物,杂质为大量 和少量
和少量 等;苛化泥的主要成分为
等;苛化泥的主要成分为 等。
等。ⅱ高温下,苛化泥的主要成分可与
 反应生成偏铝酸盐;室温下,偏钒酸钙
反应生成偏铝酸盐;室温下,偏钒酸钙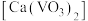 和偏铝酸钙均难溶于水。回答下列问题:
和偏铝酸钙均难溶于水。回答下列问题:(1)钒原子的价层电子排布式为
(2)水浸工序得到滤渣①和滤液,滤渣①中含钒成分为偏钒酸钙,滤液中杂质的主要成分为
(3)在弱碱性环境下,偏钒酸钙经盐浸生成碳酸钙发生反应的离子方程式为
 加压导入盐浸工序可提高浸出率的原因为
加压导入盐浸工序可提高浸出率的原因为(4)洗脱工序中洗脱液的主要成分为
(5)下列不利于沉钒过程的两种操作为
a.延长沉钒时间 b.将溶液调至碱性 c.搅拌 d.降低
 溶液的浓度
溶液的浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】氯酸钾在工业上具有广泛的应用,是焰火、照明弹等的主要成分。某研究性学习小组利用如图所示的实验装置制备氯酸钾。回答下列问题:
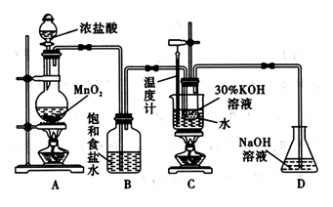
(1)写出装置A中发生反应的离子方程式:________________________________ ;写出装置C中发生反应的离子方程式:________________________________________ 。
(2)若无B装置,则装置C中氯酸钾的产率将________ (填“提高” “降低”或“无影响”)。
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究体系中硫酸浓度对反应产物的影响,实验的记录表如下表(实验在室温下进行):
①实验设计表中V1=____________ ; V3 =_______________ 。
②设计1号试管实验的作用是_________________________ 。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色。假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为_____________________________ 。
(4)工业上可用KC1O3与Na2SO3在H2SO4存在下制备高效、低毒的消毒剂ClO2,该反应的化学方程式为_________________________________ 。

(1)写出装置A中发生反应的离子方程式:
(2)若无B装置,则装置C中氯酸钾的产率将
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究体系中硫酸浓度对反应产物的影响,实验的记录表如下表(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0. 20mol • L-1KI/mL | V1 | 1.0 | 1.0 | 1.0 |
| KC1O3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol • L-1H2SO4/mL | 0 | 3.0 | V2 | 9.0 |
| 蒸馏水 | 9.0 | V3 | 3.0 | 0 |
| 实验现象 |
②设计1号试管实验的作用是
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色。假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为
(4)工业上可用KC1O3与Na2SO3在H2SO4存在下制备高效、低毒的消毒剂ClO2,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】氧化亚铜和溴化亚铜均是常见的一价铜化合物,氧化亚铜在强酸性溶液中易发生歧化反应,溴化亚铜常用作有机合成原料和反应催化剂。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为___________ g。
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到___________ ,则说明样品中含有Cu2O杂质。
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:___________ 。
_______Cu2++_______Br-+_______SO2+_______H2O=______CuBr↓+_____ +_________。
+_________。
该反应完毕的现象标志是___________ ,洗涤CuBr沉淀时采用二氧化硫的水溶液而不采用蒸馏水的目的是___________ 。
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。
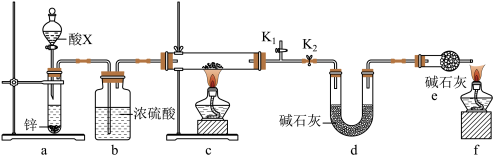
①装置a中所加的酸X是___________ (填化学式)。
②通过测定下列物理量,能达到实验目的的是___________ (填字母)。
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③点燃酒精灯前涉及的部分操作如下,正确的顺序是___________ 。
①打开K2:关闭K1②检查装置的气密性③连接仪器④关闭K2,打开K1,通氢气一段时间。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:
_______Cu2++_______Br-+_______SO2+_______H2O=______CuBr↓+_____
 +_________。
+_________。该反应完毕的现象标志是
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。

①装置a中所加的酸X是
②通过测定下列物理量,能达到实验目的的是
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③点燃酒精灯前涉及的部分操作如下,正确的顺序是
①打开K2:关闭K1②检查装置的气密性③连接仪器④关闭K2,打开K1,通氢气一段时间。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】四氢铝钠( )是强还原剂和供氢剂,高铁酸钠(
)是强还原剂和供氢剂,高铁酸钠( )是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为
)是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为 、
、 和
和 含少量
含少量 )为原料制备四氢铝钠和高铁酸钠的流程如下(已知
)为原料制备四氢铝钠和高铁酸钠的流程如下(已知 是难溶于水的酸性氧化物):
是难溶于水的酸性氧化物):

回答下列问题:
(1) 中氢的化合价为
中氢的化合价为_______ 。
(2)浸渣的主要成分是_______ (填化学式);“转化”中 的具体作用是
的具体作用是_______ 。
(3)由 制备
制备 的离子方程式为
的离子方程式为_______ ;“分离”中铝元素转化成_______ (填离子符号)。
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是_______ 。
(5)“合成”中乙醚作溶剂,发生反应的化学方程式为_______ 。
(6)“有效氢”指单位质量(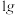 )含氢还原剂的还原能力相当于多少克氢气的还原能力。
)含氢还原剂的还原能力相当于多少克氢气的还原能力。 、
、 的“有效氢”如图所示,则乙代表
的“有效氢”如图所示,则乙代表_______ (填化学式)。

 )是强还原剂和供氢剂,高铁酸钠(
)是强还原剂和供氢剂,高铁酸钠( )是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为
)是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为 、
、 和
和 含少量
含少量 )为原料制备四氢铝钠和高铁酸钠的流程如下(已知
)为原料制备四氢铝钠和高铁酸钠的流程如下(已知 是难溶于水的酸性氧化物):
是难溶于水的酸性氧化物):
回答下列问题:
(1)
 中氢的化合价为
中氢的化合价为(2)浸渣的主要成分是
 的具体作用是
的具体作用是(3)由
 制备
制备 的离子方程式为
的离子方程式为(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是
(5)“合成”中乙醚作溶剂,发生反应的化学方程式为
(6)“有效氢”指单位质量(
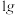 )含氢还原剂的还原能力相当于多少克氢气的还原能力。
)含氢还原剂的还原能力相当于多少克氢气的还原能力。 、
、 的“有效氢”如图所示,则乙代表
的“有效氢”如图所示,则乙代表
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】我国西北富产软锰矿,其主要成分为MnO2,还含有Al2O3、SiO2等杂质,是工业生产KMnO4的重要原料。某研究所设计由软锰矿制备KMnO4的生产流程如下。
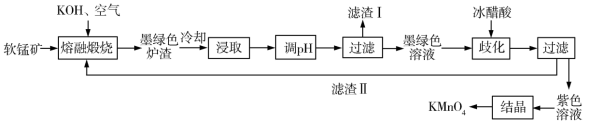
已知:①K2MnO4固体和溶液的颜色均为墨绿色。
②K2MnO4溶液中存在以下平衡:3 +2H2O⇌2
+2H2O⇌2 +MnO2+4OH-。回答下列问题:
+MnO2+4OH-。回答下列问题:
(1)“熔融煅烧”时,MnO2参与反应的化学方程式为____ 。
(2)向“浸取”液中通入CO2调节其pH,经“过滤”得滤渣Ⅰ,滤渣Ⅰ成分为____ (填化学式)。
(3)“歧化”时加入冰醋酸的目的是____ 。“歧化”时,下列酸可以用来代替冰醋酸的有____ (填标号)。
a 稀硫酸 b 亚硫酸 c 氢溴酸 d 乙二酸
(4)“结晶”时,当___ (填现象)时,停止加热,自然冷却,抽滤即可获得紫黑色 KMnO4晶体。
(5)KMnO4在酸性条件下能够与 Na2C2O4反应,生成Mn2+和CO2。取0.70 g上述所得产品,用0.5 mol·L-1 的Na2C2O4溶液滴定 3次,平均消耗Na2C2O4溶液20.00 mL。则 KMnO4样品的纯度为___ %(保留 1 位小数)。

已知:①K2MnO4固体和溶液的颜色均为墨绿色。
②K2MnO4溶液中存在以下平衡:3
 +2H2O⇌2
+2H2O⇌2 +MnO2+4OH-。回答下列问题:
+MnO2+4OH-。回答下列问题:(1)“熔融煅烧”时,MnO2参与反应的化学方程式为
(2)向“浸取”液中通入CO2调节其pH,经“过滤”得滤渣Ⅰ,滤渣Ⅰ成分为
(3)“歧化”时加入冰醋酸的目的是
a 稀硫酸 b 亚硫酸 c 氢溴酸 d 乙二酸
(4)“结晶”时,当
(5)KMnO4在酸性条件下能够与 Na2C2O4反应,生成Mn2+和CO2。取0.70 g上述所得产品,用0.5 mol·L-1 的Na2C2O4溶液滴定 3次,平均消耗Na2C2O4溶液20.00 mL。则 KMnO4样品的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】金属铝用途广泛,工业上利用铝矾土矿(主要成分是Al2O3)制备金属铝。
(1)首先获得纯净的Al2O3,其工艺流程如图:
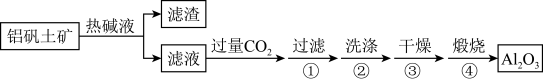
①滤液中通入过量CO2时主要反应的离子方程式是___ 。
②煅烧生成氧化铝的化学方程式是___ 。
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以碳素材料为阴极,石墨棒为阳极,进行电解。
①下列关于Al2O3的说法正确的是___ (填字母)。
A. Al2O3属于电解质 B. Al2O3属于离子化合物
C. Al2O3属于碱性氧化物 D. Al2O3的熔点低,可作耐火材料
②阳极石墨棒需要不断补充,写出电极反应式并简述其原因:________ 。
(1)首先获得纯净的Al2O3,其工艺流程如图:

①滤液中通入过量CO2时主要反应的离子方程式是
②煅烧生成氧化铝的化学方程式是
(2)将Al2O3溶解于熔融的冰晶石(助熔剂)中,以碳素材料为阴极,石墨棒为阳极,进行电解。
①下列关于Al2O3的说法正确的是
A. Al2O3属于电解质 B. Al2O3属于离子化合物
C. Al2O3属于碱性氧化物 D. Al2O3的熔点低,可作耐火材料
②阳极石墨棒需要不断补充,写出电极反应式并简述其原因:
您最近一年使用:0次



