反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法错误的是

| A.三种物质中B最不稳定 | B.A→B反应的活化能为E1 |
| C.B→C反应的ΔH=E4-E3 | D.加入催化剂不能改变反应的焓变 |
17-18高二上·广东佛山·期末 查看更多[13]
四川省自贡市第一中学校2023-2024学年高二上学期10月月考化学试题辽宁省东北育才学校高中部2023-2024学年高二上学期第一次月考化学试题广东省佛山市顺德区东逸湾实验学校2022-2023学年高二上学期9月份检测化学试题甘肃省金昌市永昌县第一高级中学2022-2023学年高二上学期第一次月考化学试题湖南省长郡中学2022-2023学年高二上学期第一次月考化学试题上海市上海中学2021-2022学年高一下学期期末考试化学试题福建省莆田市第二中学2021-2022学年高二上学期10月阶段检测化学试题广东省普宁市第二中学2021-2022学年高二上学期9月份第一次月考化学试题广东省潮州市2020-2021学年高二上学期期末考试化学试题黑龙江省绥化市安达市第七中学2019-2020学年高一下学期期中考试化学试题【全国百强校】福建省莆田市第一中学2018-2019学年高二上学期第一次月考化学试题甘肃省师范大学附属中学2018-2019学年高二上学期第一次月考化学试题广东省佛山市2017-2018学年高二上学期期末教学质量检测化学试题
更新时间:2018-01-27 12:10:05
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】下列依据热化学方程式得出的结论正确的是
| A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| B.已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g) ΔH2;则ΔH2>ΔH1 |
| C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| D.放热过程(ΔH<0)或熵增加(ΔS> 0)的过程一定是自发的 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列说法正确的是
| A.反应物用量增加后,有效碰撞次数增多,反应速率一定增大 |
| B.等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 |
| C.△H<0、△S>0的反应在任何温度下都能自发进行 |
| D.铜铁交接处,在潮湿的空气中直接发生反应:Fe-3e-=Fe3+,继而形成铁锈 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列图示与对应的叙述相符的是
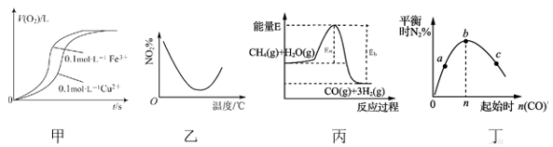

| A.图甲表示向2 mL 5%的H2O2溶液中分别滴加0.1 mol·L−1 Fe3+和Cu2+(两溶液的阴离子相同)各1 mL,生成氧气的体积随时间的变化,表明Cu2+能使反应更快 |
B.图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)  N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应ΔH>0 N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应ΔH>0 |
C.图丙表示反应CH4(g)+H2O (g) CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值 CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值 |
D.图丁表示反应2CO(g)+2NO(g) N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】在一定条件下A与B反应可生成C和D,其能量变化如下图,下列有关反应的说法正确的是


| A.反应前后原子的种类和数目一定不变 |
| B.反应前后分子的种类和数目一定改变 |
| C.反应物的总能量E1与生成物的总能量E2一定相等 |
| D.此反应一定是吸热反应 |
您最近一年使用:0次
【推荐1】工业上利用炭和水蒸气反应:C(s)+H2O(g)  CO(g)+H2(g)、CO(g)+H2O(g)
CO(g)+H2(g)、CO(g)+H2O(g)  CO2(g)+H2(g)生成的H2为原料合成氨。在饱和食盐水中先通NH3,后通CO2,由于HCO
CO2(g)+H2(g)生成的H2为原料合成氨。在饱和食盐水中先通NH3,后通CO2,由于HCO 能形成多聚体,所以容易析出NaHCO3,过滤后热分解得纯碱。
能形成多聚体,所以容易析出NaHCO3,过滤后热分解得纯碱。
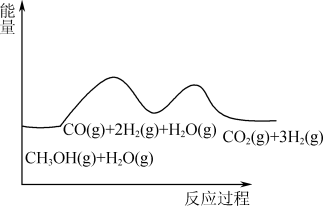
甲醇与水蒸气重整可获得清洁能源,在催化剂作用下发生如下两步反应:
反应①:CH3OH(g)=CO(g)+2H2(g);ΔH1
反应②: CO(g)+H2O(g)=CO2(g)+H2(g);ΔH2
根据能量变化示意图,下列说法不正确的是
 CO(g)+H2(g)、CO(g)+H2O(g)
CO(g)+H2(g)、CO(g)+H2O(g)  CO2(g)+H2(g)生成的H2为原料合成氨。在饱和食盐水中先通NH3,后通CO2,由于HCO
CO2(g)+H2(g)生成的H2为原料合成氨。在饱和食盐水中先通NH3,后通CO2,由于HCO 能形成多聚体,所以容易析出NaHCO3,过滤后热分解得纯碱。
能形成多聚体,所以容易析出NaHCO3,过滤后热分解得纯碱。甲醇与水蒸气重整可获得清洁能源,在催化剂作用下发生如下两步反应:
反应①:CH3OH(g)=CO(g)+2H2(g);ΔH1
反应②: CO(g)+H2O(g)=CO2(g)+H2(g);ΔH2
根据能量变化示意图,下列说法不正确的是

| A.总反应的热化学方程式为CH3OH(g)+H2O(g)=CO2(g)+3H2(g);ΔH=ΔH1+ΔH2 |
| B.1 mol CO(g)和1 mol H2O(g)的总键能大于1 mol CO2(g)和1 mol H2(g)的总键能 |
| C.甲醇与水蒸气催化重整的总反应速率取决于反应①的速率 |
| D.催化剂在反应中改变了活化能,加快了反应速率 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】中科院兰州化学物理研究所用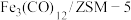 催化
催化 加氢合成低碳烯烃,反应过程如下图。在其他条件相同时,添加不同助剂(催化剂中添加助剂
加氢合成低碳烯烃,反应过程如下图。在其他条件相同时,添加不同助剂(催化剂中添加助剂 、
、 或
或 后可改变反应的选择性),经过相同时间后测得
后可改变反应的选择性),经过相同时间后测得 的转化率和各产物的物质的量分数如下表。
的转化率和各产物的物质的量分数如下表。
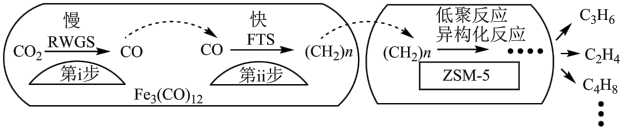
下列说法正确的是
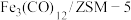 催化
催化 加氢合成低碳烯烃,反应过程如下图。在其他条件相同时,添加不同助剂(催化剂中添加助剂
加氢合成低碳烯烃,反应过程如下图。在其他条件相同时,添加不同助剂(催化剂中添加助剂 、
、 或
或 后可改变反应的选择性),经过相同时间后测得
后可改变反应的选择性),经过相同时间后测得 的转化率和各产物的物质的量分数如下表。
的转化率和各产物的物质的量分数如下表。
| 助剂 |  的转化率/% 的转化率/% | 各产物的物质的量分数/% | ||
 |  | 其他 | ||
 | 42.5 | 35.9 | 39.6 | 24.5 |
 | 27.2 | 75.6 | 22.8 | 1.6 |
 | 9.8 | 80.7 | 12.5 | 6.8 |
| A.第i步反应的活化能比第ii步的低 |
B. 加氢合成低碳烯烃时还有 加氢合成低碳烯烃时还有 生成 生成 |
C.添加 助剂时单位时间内乙烯的产量最高 助剂时单位时间内乙烯的产量最高 |
D.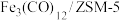 使 使 加氢合成低碳烯烃的 加氢合成低碳烯烃的 减小 减小 |
您最近一年使用:0次

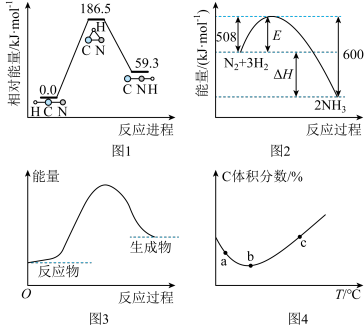
 的反应,升高温度,化学反应平衡常数会减小
的反应,升高温度,化学反应平衡常数会减小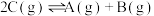
 中相同时间段测得C物质体积分数随温度变化情况,c点:
中相同时间段测得C物质体积分数随温度变化情况,c点: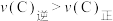
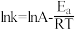 ,
,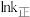 和
和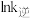 随温度变化的曲线如图。下列有关该反应的说法正确的是
随温度变化的曲线如图。下列有关该反应的说法正确的是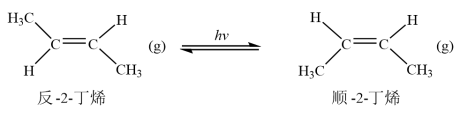
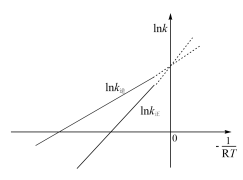
 的影响程度小于对
的影响程度小于对 的影响程度
的影响程度

