铁是应用最广泛的金属,铁的氯化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)请写出Fe与水蒸气反应的化学方程式:_____________ 。
(2)在实验室中,FeCl2可用铁粉和______ (填名称)反应制备。
(3)Fe3O4可用多种方法制得,其中由一种单质和一种化合物通过化合反应制备的化学方程式为______ 。
(4)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:_________________ 。
(5)现有一含有FeCl2 和FeCl3的混合物样品,实验测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为_________ 。
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:____________ 。
(1)请写出Fe与水蒸气反应的化学方程式:
(2)在实验室中,FeCl2可用铁粉和
(3)Fe3O4可用多种方法制得,其中由一种单质和一种化合物通过化合反应制备的化学方程式为
(4)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:
(5)现有一含有FeCl2 和FeCl3的混合物样品,实验测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:
17-18高一上·山西大同·期末 查看更多[2]
更新时间:2018-02-05 22:34:55
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】磷和砷是同主族的非金属元素。
(1)砷(As)元素位于元素周期表第____ 列;As原子能量最高的3个轨道在空间相互____ ;1个黄砷(As4)分子中含有_____ 个As﹣As键,键角_____ 度.
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于____ (选填编号).
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是_____ (选填编号).
a.磷难以与氢气直接化合 b.白磷易自燃 c.P﹣H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍﹣磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生以下镀镍反应:
___ Ni2++___ H2PO2﹣+___ H2O →____ Ni+____ H2PO3﹣+___ H+
①请配平上述化学方程式。
②上述反应中,若生成1mol H2PO3﹣,反应中转移电子的物质的量为______ 。
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
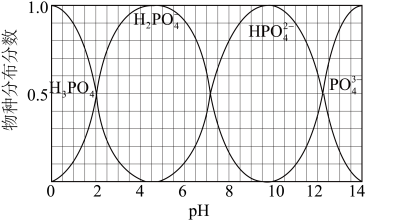
①pH=8时,溶液中主要含磷物种浓度大小关系为_________________ 。
②为获得尽可能纯的NaH2PO4,pH应控制在______________________________ 。
(1)砷(As)元素位于元素周期表第
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是
a.磷难以与氢气直接化合 b.白磷易自燃 c.P﹣H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍﹣磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生以下镀镍反应:
①请配平上述化学方程式。
②上述反应中,若生成1mol H2PO3﹣,反应中转移电子的物质的量为
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。

①pH=8时,溶液中主要含磷物种浓度大小关系为
②为获得尽可能纯的NaH2PO4,pH应控制在
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】亚硝酸(HNO2)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多。回答下列问题:
(1)亚硝酸是一种中强酸,写出其电离方程式____________________________ 。
(2)HNO2及NaNO2均可将溶液中的I-氧化为I2,这个反应可用于分析测定。
①HNO2中,N元素的化合价为_________________ 。
②在酸性条件下,NaNO2与KI按物质的量之比l:1恰好完全反应,含氮产物为_______ (填化学式)。
③要得到稳定的HN02溶液,可以往冷的浓NaNO2溶液中加入或通入某种物质,下列物质中不适合使用的
是_________ (填序号)。
a.磷酸
b.二氧化碳
c.稀硫酸
d.二氧化硫
e.次氯酸
(3)HNO2的工业制法是:将二氧化氮和一氧化氮的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液。写出该反应的化学方程式:____________ 。
(4)亚硝酸盐对人体健康的损害不亚于农药。可采用电解法除去。电解含Ce3+、NO2- 的废水除去NO2- ,其次是再生Ce4+,其原理如图所示。
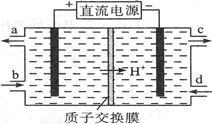
①Ce4+从电解槽的___________ (填字母序号)口流出。
②写出阴极的电极反应式_____________________ 。
(1)亚硝酸是一种中强酸,写出其电离方程式
(2)HNO2及NaNO2均可将溶液中的I-氧化为I2,这个反应可用于分析测定。
①HNO2中,N元素的化合价为
②在酸性条件下,NaNO2与KI按物质的量之比l:1恰好完全反应,含氮产物为
③要得到稳定的HN02溶液,可以往冷的浓NaNO2溶液中加入或通入某种物质,下列物质中不适合使用的
是
a.磷酸
b.二氧化碳
c.稀硫酸
d.二氧化硫
e.次氯酸
(3)HNO2的工业制法是:将二氧化氮和一氧化氮的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液。写出该反应的化学方程式:
(4)亚硝酸盐对人体健康的损害不亚于农药。可采用电解法除去。电解含Ce3+、NO2- 的废水除去NO2- ,其次是再生Ce4+,其原理如图所示。

①Ce4+从电解槽的
②写出阴极的电极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】铁盐、亚铁盐是实验室常用的药品。请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为___ 。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变红色。继续滴加双氧水,红色逐渐褪去,且有气泡生成。写出上述变化中,有关反应的离子方程式:
①___ 。
②Fe3++3SCN-=Fe(SCN)3
③11H2O2+2SCN-=2SO +2CO2↑+N2↑+10H2O+2H+若生成0.5molN2,H2O2和SCN-的反应中转移电子的物质的量是
+2CO2↑+N2↑+10H2O+2H+若生成0.5molN2,H2O2和SCN-的反应中转移电子的物质的量是___ mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为___ 。
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变红色。继续滴加双氧水,红色逐渐褪去,且有气泡生成。写出上述变化中,有关反应的离子方程式:
①
②Fe3++3SCN-=Fe(SCN)3
③11H2O2+2SCN-=2SO
 +2CO2↑+N2↑+10H2O+2H+若生成0.5molN2,H2O2和SCN-的反应中转移电子的物质的量是
+2CO2↑+N2↑+10H2O+2H+若生成0.5molN2,H2O2和SCN-的反应中转移电子的物质的量是(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】同学们在实验室里用废铁屑(含少量铜)制取FeCl3·6H2O的流程如下。
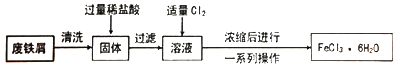
请回答下列问题。
(1)固体中加入过量稀盐酸时的现象是___________ 。
(2)溶液中通入Cl2时发生反应的化学方程式是______________ ,反应中Cl2表现出的性质是_________ ,此处的Cl2也可以用__________ 代替(填序号)。
A.H2O2 B.SO2 C.浓硫酸
(3)上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括_____ 、过滤、洗涤。
(4)用FeCl3溶液制备Fe2O3,可向FeCl3溶液中滴加足量____________ ,然后过滤、洗涤、______ ,即可得到Fe2O3。
(5)FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是______ ,反应一段时间后,取少量腐蚀液,向其中滴加_____ ,观察到_____ ,证明腐蚀液中任含Fe3+。此时腐蚀液中的金属阳离子是_______ 。

请回答下列问题。
(1)固体中加入过量稀盐酸时的现象是
(2)溶液中通入Cl2时发生反应的化学方程式是
A.H2O2 B.SO2 C.浓硫酸
(3)上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括
(4)用FeCl3溶液制备Fe2O3,可向FeCl3溶液中滴加足量
(5)FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】将铁粉和铝粉的混合物逐渐加入100mL的稀硝酸中,其产生的有关离子浓度与加入铁粉和铝粉的混合物的质量的关系如下图所示:
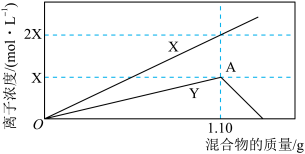
若反应过程中生成的气体为NO,溶液的体积变化忽略不计。请回答下列问题:
(1)X表示的变化离子是_______________ (填离子符号)。
(2)OA段发生反应的离子方程式是___________________________________ 。
(3)稀硝酸溶解1.10g铁粉和铝粉后溶液还能继续溶解混合物的原因是________________
(4)该硝酸的浓度是_____________ mol·L-1。

若反应过程中生成的气体为NO,溶液的体积变化忽略不计。请回答下列问题:
(1)X表示的变化离子是
(2)OA段发生反应的离子方程式是
(3)稀硝酸溶解1.10g铁粉和铝粉后溶液还能继续溶解混合物的原因是
(4)该硝酸的浓度是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】回答下列关于铁元素及其化合物的知识:
(1)除去铁粉中混有的铝粉可以选用的试剂为_________(填序号)。
(2)在常温下,铁与水并不起反应,但在高温下,铁与水蒸气可发生反应。
该反应的化学方程式_____________________________________ ;
该反应中的还原剂是____________ ,氧化剂是___________ 。
(3)实验室在保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是(用离子方程式表示)______________________________ 。
(1)除去铁粉中混有的铝粉可以选用的试剂为_________(填序号)。
| A.稀盐酸 | B.氢氧化钠溶液 | C.浓硫酸 |
该反应的化学方程式
该反应中的还原剂是
(3)实验室在保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是(用离子方程式表示)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是______
(2)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法______
(3)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是________ (结合化学方程式说明):
(4)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是_______
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有人设计如图所示的装置:

请简述实验操作及原理_______
(1)铁粉与水蒸气反应的化学方程式是
(2)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法
(3)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是
(4)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有人设计如图所示的装置:

请简述实验操作及原理
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】铁元素在地壳中含量居于第四位。铁是目前产量最大,使用最广泛的金属。我国目前发现最早的人工冶铁制品是河南三门峡出土的西周晚期的玉柄铁剑。
(1)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,请用化学方程式解释_______ 。
(2)铁是人体必需微量元素中含量最多的一种。当人体贫血时,可以服用含FeSO4的补血剂,搭配维C效果更好,维C在这个过程中的作用是做_______ 剂。
(3)电子工业中常用FeCl3溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有Fe3+,可选择下列试剂中的_______ (填编号)进行检验。
A.KSCN 溶液 B.酸性 KMnO4溶液 C.新制氯水
(4)高铁酸钠 是一种新型绿色消毒剂,其一种制备原理如下: _______
是一种新型绿色消毒剂,其一种制备原理如下: _______ _______
_______ _______=_______
_______=_______ _______
_______ _______
_______
①请将方程式补充完整并配平该方程式_______ 。
②氧化剂和还原剂个数之比为:_______ 。
(5)干法制备高铁酸钾的主要反应为: 。该反应中的还原剂是
。该反应中的还原剂是_______ ,每生成0.5mol Na2FeO4转移_______ 个电子(阿伏加德罗常数的值用NA表示)。
(1)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,请用化学方程式解释
(2)铁是人体必需微量元素中含量最多的一种。当人体贫血时,可以服用含FeSO4的补血剂,搭配维C效果更好,维C在这个过程中的作用是做
(3)电子工业中常用FeCl3溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有Fe3+,可选择下列试剂中的
A.KSCN 溶液 B.酸性 KMnO4溶液 C.新制氯水
(4)高铁酸钠
 是一种新型绿色消毒剂,其一种制备原理如下: _______
是一种新型绿色消毒剂,其一种制备原理如下: _______ _______
_______ _______=_______
_______=_______ _______
_______ _______
_______
①请将方程式补充完整并配平该方程式
②氧化剂和还原剂个数之比为:
(5)干法制备高铁酸钾的主要反应为:
 。该反应中的还原剂是
。该反应中的还原剂是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请回答下列问题
(1)31号元素镓(Ga)与铝同族。镓(Ga)在周期表的位置是___________ ;写出镓的氯化物和氨水反应的化学方程式___________ 。铍、铝二者的单质、化合物均具有相似的化学性质,写出BeCl2溶液与Na2BeO2的水溶液混合的化学方程式___________ 。
(2)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,不正确的是___________(填字母)
(3)在稀 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为
恰好完全沉淀,此时铝元素的存在形式主要为___________ (用化学式表示)。
(4)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
①该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理___________ (填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所涉及的反应的离子方程式为___________ 。
③另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由:___________ 。
(1)31号元素镓(Ga)与铝同族。镓(Ga)在周期表的位置是
(2)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,不正确的是___________(填字母)
| A.青铜、不锈钢、硬铝都是合金 |
| B.铜表面易形成致密的氧化膜 |
| C.铜与O2反应生成黑色的CuO |
| D.CuSO4·5H2O是一种混合物,加热后变为白色固体 |
 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为
恰好完全沉淀,此时铝元素的存在形式主要为(4)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
①该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所涉及的反应的离子方程式为
③另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.该同学的实验方案是否合理?
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】按要求回答问题:
(1)区分溶液与胶体最常用的方法______________ 。
(2)用量最大、用途最广的合金是______________ 。
(3)氡的放射性同位素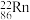 ,其原子中的质子数为
,其原子中的质子数为______________ 。
(4)用 溶液腐蚀印刷电路板的离子方程式
溶液腐蚀印刷电路板的离子方程式______________ 。
(5)只用一种试剂就可将 、稀
、稀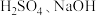 四种无色溶液区分开,该试剂是
四种无色溶液区分开,该试剂是______________ 。
(6)用 代表阿伏加德罗常数的值,
代表阿伏加德罗常数的值, 含有的电子数为
含有的电子数为______________  。
。
(7)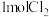 与足量
与足量 反应,转移的电子的物质的量为
反应,转移的电子的物质的量为______________  。
。
(8) 的结构式
的结构式______________ 。
(9)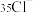 的结构示意图
的结构示意图______________ 。
(10)中子数为10的氟原子符号______________ 。
(11)甲烷分子的空间结构模型______________ 。
(1)区分溶液与胶体最常用的方法
(2)用量最大、用途最广的合金是
(3)氡的放射性同位素
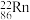 ,其原子中的质子数为
,其原子中的质子数为(4)用
 溶液腐蚀印刷电路板的离子方程式
溶液腐蚀印刷电路板的离子方程式(5)只用一种试剂就可将
 、稀
、稀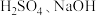 四种无色溶液区分开,该试剂是
四种无色溶液区分开,该试剂是(6)用
 代表阿伏加德罗常数的值,
代表阿伏加德罗常数的值, 含有的电子数为
含有的电子数为 。
。(7)
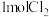 与足量
与足量 反应,转移的电子的物质的量为
反应,转移的电子的物质的量为 。
。(8)
 的结构式
的结构式(9)
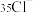 的结构示意图
的结构示意图(10)中子数为10的氟原子符号
(11)甲烷分子的空间结构模型
您最近一年使用:0次

 的形式存在。回答下列问题:
的形式存在。回答下列问题:



