下列各组变化中,化学反应的反应热前者大于后者的一组是
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1;
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2;
②2H2(g)+O2(g)=2H2O(l)△H1;
H2(g)+½O2(g)=H2O(l)△H2
③t℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g)△H1;
CaO(s)+H2O(l)=Ca(OH)2(s)△H2
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1;
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2;
②2H2(g)+O2(g)=2H2O(l)△H1;
H2(g)+½O2(g)=H2O(l)△H2
③t℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g)△H1;
CaO(s)+H2O(l)=Ca(OH)2(s)△H2
| A.③④ | B.②③ | C.①② | D.①④ |
更新时间:2018-03-12 19:43:45
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】我国科学家使用双功能催化剂(能吸附不同粒子,脱附后催化剂复原)催化水煤气变换反应: ,低温获得高转化率与高反应速率,反应过程示意如图:
,低温获得高转化率与高反应速率,反应过程示意如图:
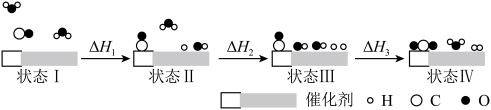
下列说法正确的是
 ,低温获得高转化率与高反应速率,反应过程示意如图:
,低温获得高转化率与高反应速率,反应过程示意如图:
下列说法正确的是
A.图示显示,状态Ⅰ的 分子在变换过程中均参与了反应 分子在变换过程中均参与了反应 |
| B.若未使用催化剂时水煤气变换反应的焓变为∆H′,则∆H′<∆H |
| C.从状态Ⅲ到状态Ⅳ,存在非极性共价键的断裂和生成 |
D.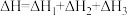 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法不正确 的是( )
| A.已知冰的熔化热为6.0kJ﹒mol-1,冰中氢键键能为20 kJ﹒mol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 |
| B.实验测得环己烷(1)、环己烯(1)和苯(1)的标准燃烧热分别为-3916kJ/mol-1、-3747kJ/mol-1和-3265kJ/mol-1,可以证明在苯分子中不存在独立的碳碳双键 |
| C.已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=489.0kJ/mol CO(g)+  O2(g)=CO2(g) △H=-283.0kJ/mol O2(g)=CO2(g) △H=-283.0kJ/molC(石墨)+O2(g)=CO2(g) △H=-393.5kJ/mol 则4Fe(s)+3O2(g)=2Fe2O3(g) △H=-1641.0kJ·mol-1 |
| D.除干燥CH4中混有的少量C2H4,将混合气体依次通过盛有酸性KMnO4溶液,浓硫酸的洗气瓶 |
您最近半年使用:0次

 催化重整
催化重整 的反应:(I)
的反应:(I)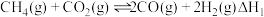 ,主要副反应:(II)
,主要副反应:(II)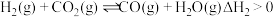 ,(III)
,(III) 。
。 充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法正确的是
充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法正确的是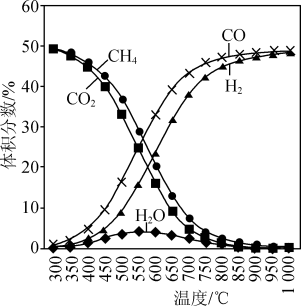
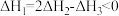
 ,可抑制副反应(II)、(III)的进行
,可抑制副反应(II)、(III)的进行 时,
时, 时,在
时,在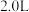 容器中加入
容器中加入 、
、 以及催化剂进行重整反应,测得
以及催化剂进行重整反应,测得

