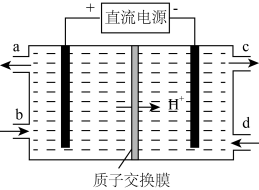
如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.根据要求回答相关问题:
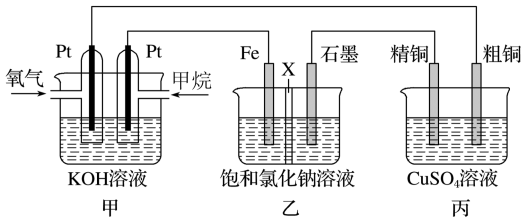
(1)甲烷燃料电池的负极反应式______ .
(2)石墨电极(C)的电极反应式为______ .
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将______ (填“增大”“减小”或“不变”).
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成标况下气体的的体积为______ ;丙装置中阴极析出铜的质量为______ .

(1)甲烷燃料电池的负极反应式
(2)石墨电极(C)的电极反应式为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成标况下气体的的体积为
更新时间:2018-03-12 19:43:45
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是_______ 。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)⇌C(s)+H2O(1)△H=﹣QkJ•mol-1,则Q<131.4
d.若C(s)+CO2(g)⇌2CO(g)△H1;CO(g)+H2O(g)⇌H2(g)+CO2(g)△H2则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
根据表中数据计算:
①0min~2min 内H2的平均反应速率为_____________________ 。
②达平衡时,CH4的转化率为_____________ ;在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比___________ (填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有__________ (填字母)。
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3υ正(CH4)=υ逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过):
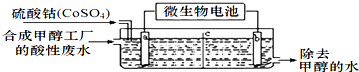
①a电极的名称为__________ 。
②写出除去甲醇的离子方程式______________________ 。
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为__________________ 。
(1)制取H2和CO通常采用:C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)⇌C(s)+H2O(1)△H=﹣QkJ•mol-1,则Q<131.4
d.若C(s)+CO2(g)⇌2CO(g)△H1;CO(g)+H2O(g)⇌H2(g)+CO2(g)△H2则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0min~2min 内H2的平均反应速率为
②达平衡时,CH4的转化率为
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3υ正(CH4)=υ逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过):

①a电极的名称为
②写出除去甲醇的离子方程式
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲醇是一种可再生能源,用途广泛。请回答下列问题:
(1)一种用CO2生产甲醇燃料的反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-akJ•mol-1。
已知:CH3OH(g)=CH3OH(l) ΔH=-bkJ•mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-ckJ•mol-1;
H2O(g)=H2O(l) ΔH=-dkJ•mol-1。
则表示CH3OH(l)摩尔燃烧焓的热化学方程式为________ 。
(2)用如图所示装置研究有关电化学问题,当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
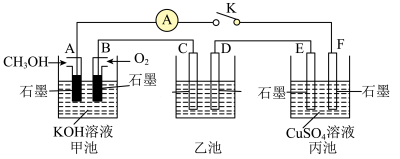
①A电极的电极反应式为________ ,C电极的电势________ (填“低于”或“高于”)D电极的电势。
②若在乙池中实现铁表面镀银,则D电极材料为________ ,乙池中的溶液为________ 。
③丙池中装有200mL1mol•L-1硫酸铜溶液,若B电极消耗3.36L(标准状况)气体,若要使电解质溶液恢复到电解前的状态,应加入________ (填字母)。
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图像分析,与汽油相比,甲醇作为燃料的优点是________ 。
(1)一种用CO2生产甲醇燃料的反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-akJ•mol-1。
已知:CH3OH(g)=CH3OH(l) ΔH=-bkJ•mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-ckJ•mol-1;
H2O(g)=H2O(l) ΔH=-dkJ•mol-1。
则表示CH3OH(l)摩尔燃烧焓的热化学方程式为
(2)用如图所示装置研究有关电化学问题,当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:

①A电极的电极反应式为
②若在乙池中实现铁表面镀银,则D电极材料为
③丙池中装有200mL1mol•L-1硫酸铜溶液,若B电极消耗3.36L(标准状况)气体,若要使电解质溶液恢复到电解前的状态,应加入
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图像分析,与汽油相比,甲醇作为燃料的优点是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜、装置Ⅲ实现粗铜的精炼。

(1)a处应通入__ (填“CH4”或“O2”),b处电极上发生的电极反应式是_______ 。
(2)电镀结束后,理论上装置Ⅰ中溶液的pH__ (填“变大”“变小”或“不变”)。
(3)装置I中消耗1.12L(标准状况下)的CH4时,装置II中Cu电极质量减少的质量为___ 。
(4)粗铜的电解精炼如图所示,在粗铜的电解过程中,d电极上发生的电极反应为________ ;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是______ 。

(1)a处应通入
(2)电镀结束后,理论上装置Ⅰ中溶液的pH
(3)装置I中消耗1.12L(标准状况下)的CH4时,装置II中Cu电极质量减少的质量为
(4)粗铜的电解精炼如图所示,在粗铜的电解过程中,d电极上发生的电极反应为
您最近一年使用:0次
【推荐1】硫是生物必须的营养元素之一,含硫化合物在自然界中广泛存在,循环关系如下图所示:
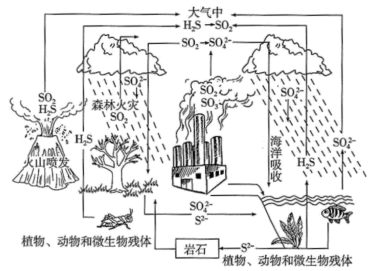
(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成 CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝( CuS), 请用化学用语表示 ZnS 转变为 CuS 的过程__________ 。
(2) 火山喷发产生 H2S 在大气当中发生如下反应:
①2H2S(g)+O2(g) =2S(g) +2H2O(g) △H=﹣442.38kJ/mol
②S(g)+O2(g)=SO2(g) △ H=﹣297.04kJ/mol。
H2S(g)与 O2(g)反应产生 SO2(g)和 H2O(g)的热化学方程式是__________ 。
(3) 降低 SO2的排放量已经写入 2018 年政府工作报告, 化石燃料燃烧时会产生含 SO2的废气进入大气,污染环境,有多种方法可用于 SO2的脱除。
①NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收 SO2。
i.反应离子方程式是__________ 。
为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对 SO2的吸收。该催化过程的示意图如下图所示:
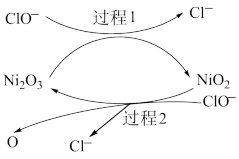
ii.过程 1 的离子方程式是__________ 。
iii.Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,原因是__________ 。
②电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2还可以制得 H2SO4。
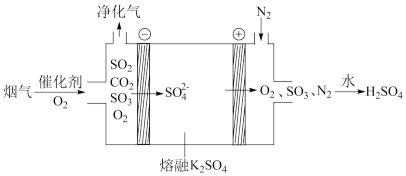
i.在阴极放电的物质是______ 。
ii.在阳极生成 SO3的电极反应式是______ 。

(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成 CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝( CuS), 请用化学用语表示 ZnS 转变为 CuS 的过程
(2) 火山喷发产生 H2S 在大气当中发生如下反应:
①2H2S(g)+O2(g) =2S(g) +2H2O(g) △H=﹣442.38kJ/mol
②S(g)+O2(g)=SO2(g) △ H=﹣297.04kJ/mol。
H2S(g)与 O2(g)反应产生 SO2(g)和 H2O(g)的热化学方程式是
(3) 降低 SO2的排放量已经写入 2018 年政府工作报告, 化石燃料燃烧时会产生含 SO2的废气进入大气,污染环境,有多种方法可用于 SO2的脱除。
①NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收 SO2。
i.反应离子方程式是
为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对 SO2的吸收。该催化过程的示意图如下图所示:

ii.过程 1 的离子方程式是
iii.Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,原因是
②电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2还可以制得 H2SO4。

i.在阴极放电的物质是
ii.在阳极生成 SO3的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】I.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁。
已知:a.Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) △H=+489.0 kJ·mol-1
b.C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol-1
则CO(g)还原Fe2O3(s)的热化学方程式为___________________ 。
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图所示。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图所示。

①曲线对应的平衡常数大小关系为KI_____ (填“>”“=”或“<”)KII。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为___________ 。
(3)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如图所示。在0~15h内,CH4的平均生成速率I、II和III从大到小的顺序为_____________ 。

II.固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图所示。

(1)b为电源的_________ (填“正极”或“负极”);
(2)写出电极c发生的电极反应式:______ 、______ 。
(1)CO可用于炼铁。
已知:a.Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) △H=+489.0 kJ·mol-1
b.C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol-1
则CO(g)还原Fe2O3(s)的热化学方程式为
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图所示。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图所示。
①曲线对应的平衡常数大小关系为KI
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2、cmolCH3OH(g)、cmolH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为
(3)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如图所示。在0~15h内,CH4的平均生成速率I、II和III从大到小的顺序为

II.固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图所示。

(1)b为电源的
(2)写出电极c发生的电极反应式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
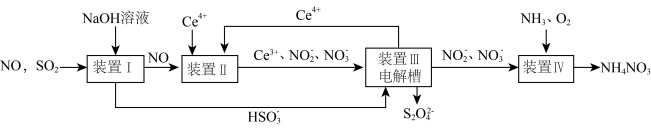
(1)装置Ⅰ中生成HSO3-的离子方程式为_____ 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
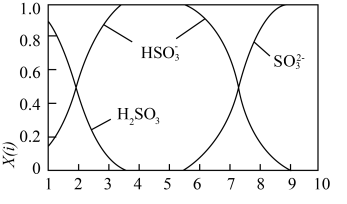
①下列说法正确的是_____ (填字母序号)。
A.pH=8时,溶液中c(HSO3-) <c(SO32-)
B.pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO32-)
C.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:_____ 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式____ 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。
①生成Ce4+的电极反应式为_________ 。
②生成Ce4+从电解槽的_____ (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2___ L。(用含a代数式表示,计算结果保留整数)

(1)装置Ⅰ中生成HSO3-的离子方程式为
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①下列说法正确的是
A.pH=8时,溶液中c(HSO3-) <c(SO32-)
B.pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO32-)
C.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。

①生成Ce4+的电极反应式为
②生成Ce4+从电解槽的
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
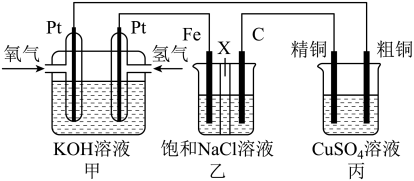
(1)石墨电极为_______ (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入”酚酞溶液,_______ (填“铁极”或“石墨极”)区的溶液先变红。乙池中电解总反应化学方程式为_______ 。
(2)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,溶液中硫酸铜浓度将_______ (填“增大”“减小”或“不变”)。精铜电极上的电极反应式为_______ 。
(3)若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为_______ mL;丙装置中阴极析出铜的质量为_______ g。
(4)若将甲改用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得燃料电池,则该电池正极反应式为_______ 。

(1)石墨电极为
(2)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,溶液中硫酸铜浓度将
(3)若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为
(4)若将甲改用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得燃料电池,则该电池正极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜(甲醚具有可燃性,是一种常用的燃料)。
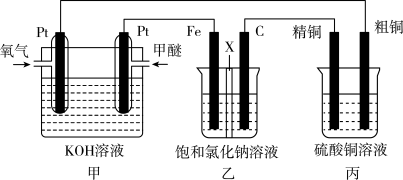
根据要求回答相关问题
(1)装置甲中通入燃料甲醚的一极是________ (填“正极”或“负极”),写出正极的电极反应式:________ 。
(2)装置乙中Fe为________ 极(填“阳极”或“阴极”),石墨电极(C)的电极反应式为:________ 。
(3)如果粗铜中含有锌、银等杂质,丙装置的阳极泥中含有________ ,反应一段时间后,硫酸铜溶液浓度将________ (填“增大”、“减小”或“不变”)。
(4)当装置甲中消耗0.05mol O2时,装置乙中溶液的pH为________ (溶液体积为200mL不变)。

根据要求回答相关问题
(1)装置甲中通入燃料甲醚的一极是
(2)装置乙中Fe为
(3)如果粗铜中含有锌、银等杂质,丙装置的阳极泥中含有
(4)当装置甲中消耗0.05mol O2时,装置乙中溶液的pH为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】电化学原理在工业生产、物质制备、污染物理处理等方面应用广泛,请按要求回答下列问题。
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。
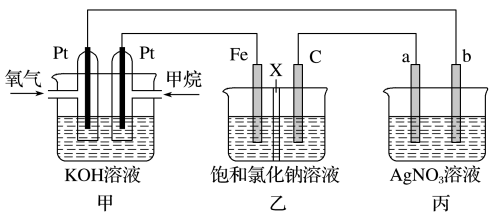
请按要求回答相关问题:
(1)乙中X是_______ 交换膜,甲烷燃料电池负极电极反应式是_______ 。
(2)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成气体的物质的量为_______ 。
(3)欲用丙装置给铜镀银,b应是_______ (填化学式)。
(4)将0.2 mol AgNO3、0.4 mol Cu(NO3)2、0.6 mol KCl溶于水,配成100 mL溶液,用惰性电极电解一段时间后,某一电极上析出了0.3 mol Cu,此时在另一电极上产生的气体体积(标准状况)为_______ L
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。

请按要求回答相关问题:
(1)乙中X是
(2)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成气体的物质的量为
(3)欲用丙装置给铜镀银,b应是
(4)将0.2 mol AgNO3、0.4 mol Cu(NO3)2、0.6 mol KCl溶于水,配成100 mL溶液,用惰性电极电解一段时间后,某一电极上析出了0.3 mol Cu,此时在另一电极上产生的气体体积(标准状况)为
您最近一年使用:0次



