新型电池在飞速发展的信息技术中发挥着越来越重要的作用。
Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4=Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
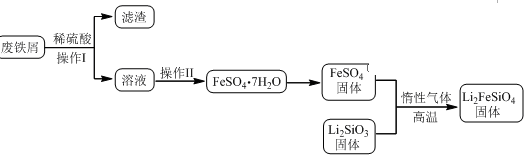
实验(二) Li2FeSiO4含量测定:
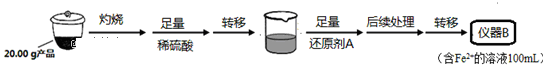
从仪器B中取20.00mL溶液至锥形瓶中,另取0.20mol•L-1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
(1)实验(二)中的仪器名称:仪器B____ ,仪器C____ 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是____ 。
(3)在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需____ ;
(4)操作Ⅱ的步骤是:__ 、__ 、过滤、洗涤。
(5)还原剂A可用SO2,写出该反应的离子方程式____ ,此时后续处理的主要目的是____ 。
(6)滴定终点时现象为____ ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为____ ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量____ (填“偏高”、“偏低”或“不变”)。
Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4=Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:

实验(二) Li2FeSiO4含量测定:

从仪器B中取20.00mL溶液至锥形瓶中,另取0.20mol•L-1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 22.40mL | 20.02mL |
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是
(3)在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需
(4)操作Ⅱ的步骤是:
(5)还原剂A可用SO2,写出该反应的离子方程式
(6)滴定终点时现象为
更新时间:2018-09-08 18:32:18
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】三水乳酸亚铁晶体[(CH3CHOHCOO)2Fe•3H2O,Mr=288]是一种很好的补铁剂,易溶于水,吸收效果比无机铁好。可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3== FeCO3↓+Na2SO4
FeCO3+ 2CH3CHOHCOOH ==(CH3CHOHCOO)2Fe+CO2↑+H2O
(1)制备FeCO3时,选用的加料方式是______ (填字母),原因是_______________________ 。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是__________________ 。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。
①铁粉的作用是_____________________ 。
②反应结束后,无需过滤,除去过量铁粉的方法及反应方程式是______________________________________ 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得三水乳酸亚铁晶体。分离过程中加入无水乙醇的目的是_______________ 。
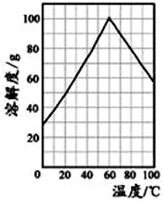
(5)某研究性学习小组从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,经过一系列的实验步骤,最后制得到了硫酸亚铁溶液。请结合如图的绿矾溶解度曲线,将FeSO4溶液____________ ,得到FeSO4·7H2O晶体。
(6)该兴趣小组用标准KMnO4溶液测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数,发现产品的质量分数总是大于100%,其原因可能是____________________ 。经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol•L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)219.7mL。滴定反应为Ce4++Fe2+═Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为__________ 。
FeSO4+Na2CO3== FeCO3↓+Na2SO4
FeCO3+ 2CH3CHOHCOOH ==(CH3CHOHCOO)2Fe+CO2↑+H2O
(1)制备FeCO3时,选用的加料方式是
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。
①铁粉的作用是
②反应结束后,无需过滤,除去过量铁粉的方法及反应方程式是
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得三水乳酸亚铁晶体。分离过程中加入无水乙醇的目的是
(5)某研究性学习小组从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,经过一系列的实验步骤,最后制得到了硫酸亚铁溶液。请结合如图的绿矾溶解度曲线,将FeSO4溶液

(6)该兴趣小组用标准KMnO4溶液测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数,发现产品的质量分数总是大于100%,其原因可能是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是________ 。
(2)已知Ksp(AgCl)=1.8×10-10,向VmL0.018mol/L 的AgNO3溶液加VmL0.020mol/L 的盐酸,混合后溶液中的Ag+的浓度为______ mol/L,pH 为________ 。
(3)AgNO3溶液光照易分解,生成Ag 和红棕色气体等物质,其光照分解的化学方程式为________ 。
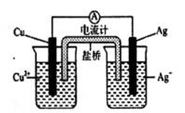
(4)如图所示原电池正极的反应式为_________ 。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是
(2)已知Ksp(AgCl)=1.8×10-10,向VmL0.018mol/L 的AgNO3溶液加VmL0.020mol/L 的盐酸,混合后溶液中的Ag+的浓度为
(3)AgNO3溶液光照易分解,生成Ag 和红棕色气体等物质,其光照分解的化学方程式为
(4)如图所示原电池正极的反应式为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】I.某学生利用下图装置测定反应过程中所放出的热量并计算中和热。所用药品为50ml 0.50mol·L-1盐酸与50ml 0.55mol·L-1NaOH溶液。请回答下列问题:
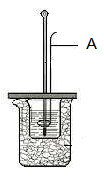
(1)图中A仪器名称为__________ 。其作用为__________ 。
(2)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是____________ 。
A.测量盐酸的温度后,温度计没有用水冲洗干净,立即去测量氢氧化钠溶液的温度
B.把量筒中的氢氧化钠溶液一次性快速倒入小烧杯
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
II.(1)原电池是将化学能转化为电能的装置,现将下列化学反应设计成带盐桥原电池,请你画出该原电池装置简图(标明电极材料名称和试剂名称):Zn+CuSO4= ZnSO4+Cu_________
(2)盐桥中的阴离子向_________ (填正极或负极)迁移。
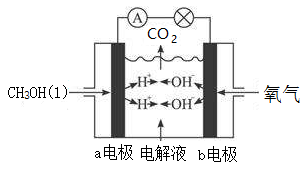
III.下图为甲醇(CH3OH)燃料电池装置,该装置能量转化率可达90%,当通入67.2L(标况下)氧气时,产生1306kJ电能,则甲醇液体的燃烧热的热化学方程式为____________ 。

(1)图中A仪器名称为
(2)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净,立即去测量氢氧化钠溶液的温度
B.把量筒中的氢氧化钠溶液一次性快速倒入小烧杯
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
II.(1)原电池是将化学能转化为电能的装置,现将下列化学反应设计成带盐桥原电池,请你画出该原电池装置简图(标明电极材料名称和试剂名称):Zn+CuSO4= ZnSO4+Cu
(2)盐桥中的阴离子向
III.下图为甲醇(CH3OH)燃料电池装置,该装置能量转化率可达90%,当通入67.2L(标况下)氧气时,产生1306kJ电能,则甲醇液体的燃烧热的热化学方程式为

您最近一年使用:0次



