其他条件不变,增大反应物的浓度能增大反应速率的原因是
| A.单位体积内分子数增多 | B.单位体积内活化分子数增多 |
| C.活化分子百分数增大 | D.分子碰撞的次数增多 |
更新时间:2018-10-09 19:55:07
|
相似题推荐
单选题
|
较易
(0.85)
【推荐1】下列说法正确的是
| A.活化分子间所发生的碰撞即为有效碰撞 |
| B.能够发生有效碰撞的分子叫做活化分子,活化分子具有的平均能量叫活化能 |
| C.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 |
| D.升高温度能使化学反应速率增大,是因为增加了反应物中活化分子的百分数 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】根据反应Br+H2 HBr+H的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是
HBr+H的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是
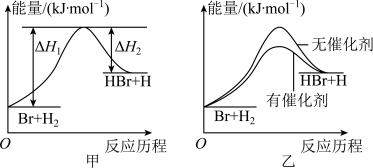
 HBr+H的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是
HBr+H的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是
| A.正反应吸热 |
| B.加入催化剂可增大正反应速率,降低逆反应速率 |
| C.加入催化剂后,该反应的能量对反应历程的示意图可用图乙表示 |
| D.加入催化剂,该化学反应的焓变不变 |
您最近一年使用:0次



