有关AgCl沉淀的溶解平衡说法正确的是( )
| A.升高温度,AgCl沉淀的溶解度变小 |
| B.AgCl难溶于水,溶液中没有Ag+ 和Cl- |
| C.溶解平衡时,AgCl沉淀生成和溶解不断进行,但速率相等 |
| D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶度积Ksp变小 |
更新时间:2018-10-22 12:58:31
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,原理如下:
Cu(s)+Cu2+(aq) 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl-(aq)+Cu+(aq) CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。

下列说法正确的是
Cu(s)+Cu2+(aq)
 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1Cl-(aq)+Cu+(aq)
 CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。

下列说法正确的是
| A.溶液pH越大,Ksp(CuCl)增大 |
| B.反应达到平衡时增大c(Cu2+),c(Cl-)减小 |
| C.向电解液中加入稀硫酸,有利于Cl-的去除 |
D. Cu(s)+ Cu(s)+ Cu2+(aq)+Cl-(aq) Cu2+(aq)+Cl-(aq) CuCl(s) ΔH=(a+2b) kJ·mol-1 CuCl(s) ΔH=(a+2b) kJ·mol-1 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】根据下列图示所得出的结论正确的是


A.图甲表示反应X(g)+3Y(g) 2Z(g)的能量变化,若更换高效催化剂,则E3不变 2Z(g)的能量变化,若更换高效催化剂,则E3不变 |
B.图乙表示密闭容器中CH4(g)+H2O(g) CO(g)+3H2(g)到达平衡时,CH4的转化率与压强、温度的变化关系曲线,则p1<p2 CO(g)+3H2(g)到达平衡时,CH4的转化率与压强、温度的变化关系曲线,则p1<p2 |
| C.图丙表示一定温度下,冰醋酸加水稀释过程中溶液导电能力的变化,则b点时醋酸电离程度最大 |
| D.图丁表示t°C时,Ag2CrO4的沉淀溶解平衡曲线,向Ag2CrO4的悬浊液中加入K2CrO4可使溶液由Y点变到X点 |
您最近半年使用:0次
【推荐1】硫化镉(CdS)是一种难溶于水的黄色颜料,在水溶液中存在如下沉淀溶解平衡:CdS(s) Cd2+(aq)+S2-(aq) △H>0,其沉淀溶解平衡曲线如图所示。下列说法错误的是
Cd2+(aq)+S2-(aq) △H>0,其沉淀溶解平衡曲线如图所示。下列说法错误的是
 Cd2+(aq)+S2-(aq) △H>0,其沉淀溶解平衡曲线如图所示。下列说法错误的是
Cd2+(aq)+S2-(aq) △H>0,其沉淀溶解平衡曲线如图所示。下列说法错误的是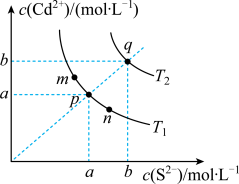
| A.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动 |
| B.图中温度T1<T2 |
| C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 |
| D.图中各点对应的Ksp的关系为Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节诱发关节疼痛,其化学历程为:
①HUr(尿酸)+H2O Ur-(尿酸根离子)+H3O+;
Ur-(尿酸根离子)+H3O+;
②Ur-(aq)+Na+(aq) NaUr(s)37℃时Ksp(NaUr)=6.4×10-6
NaUr(s)37℃时Ksp(NaUr)=6.4×10-6
下列叙述中错误的是
①HUr(尿酸)+H2O
 Ur-(尿酸根离子)+H3O+;
Ur-(尿酸根离子)+H3O+;②Ur-(aq)+Na+(aq)
 NaUr(s)37℃时Ksp(NaUr)=6.4×10-6
NaUr(s)37℃时Ksp(NaUr)=6.4×10-6下列叙述中错误的是
| A.反应的ΔH<0 | B.减少食盐的摄入,缓解疼痛症状 |
| C.Ksp(NaUr)随着温度的降低而降低 | D.升高温度,平衡向正反应方向移动 |
您最近半年使用:0次

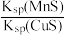
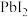 固体配成饱和溶液,t时刻改变某一外界条件,离子浓度随时间变化如图所示。下列有关说法正确的是
固体配成饱和溶液,t时刻改变某一外界条件,离子浓度随时间变化如图所示。下列有关说法正确的是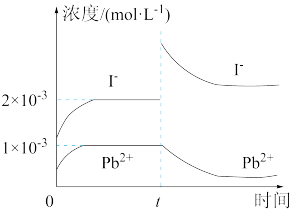
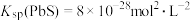 ,向
,向 溶液,反应
溶液,反应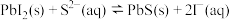 的化学平衡常数的数值为
的化学平衡常数的数值为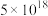

 固体,
固体,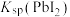 增大
增大 浓溶液,平衡向左移动,
浓溶液,平衡向左移动, 的浓度减小
的浓度减小

