已知Ca(OH)2和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42—(aq)+ Ca(OH)2(s)  CaWO4(s)+2OH-(aq)。
CaWO4(s)+2OH-(aq)。
(1)如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。
①计算T1时Ksp(CaWO4)=________ 。
②T1________ T2(填“>”、“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如表所示:
①该反应平衡常数K的表达式为________________ 。
②该反应的ΔH________ 0(填“>”、“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42—的沉淀率为60%,计算实验测得的平衡常数________________ 。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析作用:__________________ 。
 CaWO4(s)+2OH-(aq)。
CaWO4(s)+2OH-(aq)。(1)如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。

①计算T1时Ksp(CaWO4)=
②T1
(2)反应Ⅰ的平衡常数K理论值如表所示:
| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
①该反应平衡常数K的表达式为
②该反应的ΔH
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42—的沉淀率为60%,计算实验测得的平衡常数
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析作用:
更新时间:2018-11-06 21:33:41
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】碳和氮的化合物是广泛的化工原料,回答下列问题:
I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应为______ 反应(填“吸热”、“放热”)。
(2)某温度下,平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度为_____ ℃。
(3)1200℃时,在某刻体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡向____ 移动(填“正向”、“逆向”或“不”)。
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题。
(4)在1000K下,在某恒容容器中发生下列反应:2NO2(g)⇌2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图1所示。图中a点对应温度下。已知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
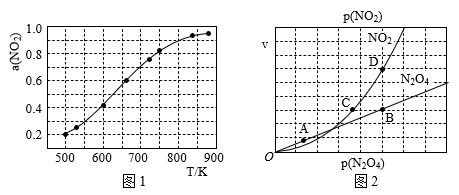
(5)对于反应N2O4(g)⇌2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2•p2(NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图2所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=______ ;在图标出点中,指出能表示反应达到平衡状态的两个点_____ ,理由是_____ 。
I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为
(2)某温度下,平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度为
(3)1200℃时,在某刻体系中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡向
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题。
(4)在1000K下,在某恒容容器中发生下列反应:2NO2(g)⇌2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图1所示。图中a点对应温度下。已知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=

(5)对于反应N2O4(g)⇌2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2•p2(NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图2所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。反应可表示为:CO2(g)+3H2(g)⇌CH3OH(g) + H2O (g)
(1)该反应平衡常数的表达式K=_______ ;
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。
(3)在5L密闭容器中充入1mol CO2和3mol H2,测得一定时间内混合气体中CH3OH的体积分数φ(CH3OH)与温度的关系如图所示。
①若温度为T时,反应10分钟,φ(CH3OH)=30%,则0~10分钟内,CH3OH的平均反应速率ʋ=_______ 。
②该反应是_______ 反应(选填“吸热”或“放热”);其它条件相同时,CH3OH在a点的正反应速率_______ CH3OH在b点的正反应速率(选填“>”、“<”或“=”);解释温度低于T时,φ(CH3OH)随温度升高而逐渐增加的原因_______ 。
(1)该反应平衡常数的表达式K=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。
| A.增大H2的浓度,平衡向右移动 |
| B.移去部分CH3OH,正反应速率增大 |
| C.降低反应温度,正、逆反应速率都减小 |
| D.加入催化剂,可提高CO2的平衡转化率 |
(3)在5L密闭容器中充入1mol CO2和3mol H2,测得一定时间内混合气体中CH3OH的体积分数φ(CH3OH)与温度的关系如图所示。

①若温度为T时,反应10分钟,φ(CH3OH)=30%,则0~10分钟内,CH3OH的平均反应速率ʋ=
②该反应是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】有科学家正在研究用碳与一氧化氮反应处理环境问题:
C(s)+2NO(g)⇌CO2(g)+N2(g) ΔH
(1)实验方案中有下列措施:
①采用加热提高反应速率
②使用催化剂提高反应速率
③使用加压(压缩体积)提高NO的转化率
④使CO2转化成干冰从体系中脱离提高NO的转化率。
其中你认为可行的是_______ 。
(2)这个反应的平衡常数表达式是_______ 。
(3)在恒容恒温密闭容器中,科学家得到表中实验数据:
求出该反应在该温度下的平衡常数K=_______ 。
(4)若在(3)的实验中,30 min时开始升温,36 min时达到平衡,测得NO的转化率变为50%,则该反应的ΔH_______ 0(填“>”“<”或“=”),判断的理由是_______ 。
(5)若科学家在30 min后改变了某一条件,反应进行到40 min时达到平衡,浓度分别为c(NO)=0.032mol·L-1,c(N2)=0.034 mol·L-1,c(CO2)=0.017 mol·L-1,则改变的条件可能是_______ 。
C(s)+2NO(g)⇌CO2(g)+N2(g) ΔH
(1)实验方案中有下列措施:
①采用加热提高反应速率
②使用催化剂提高反应速率
③使用加压(压缩体积)提高NO的转化率
④使CO2转化成干冰从体系中脱离提高NO的转化率。
其中你认为可行的是
(2)这个反应的平衡常数表达式是
(3)在恒容恒温密闭容器中,科学家得到表中实验数据:
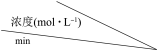 | NO | N2 | CO2 | |
| 0 | 0.100 | 0 | 0 | |
| 10 | 0.058 | 0.021 | 0.021 | |
| 20 | 0.040 | 0.030 | 0.030 | |
| 30 | 0.040 | 0.030 | 0.030 |
(4)若在(3)的实验中,30 min时开始升温,36 min时达到平衡,测得NO的转化率变为50%,则该反应的ΔH
(5)若科学家在30 min后改变了某一条件,反应进行到40 min时达到平衡,浓度分别为c(NO)=0.032mol·L-1,c(N2)=0.034 mol·L-1,c(CO2)=0.017 mol·L-1,则改变的条件可能是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+=Mg2++2H2O,常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含Mg2+的物质的量浓度为___________ mol·L-1。已知常温下,Ksp[Mg(OH)2]=5.6×10-12,当电解质溶液的pH=6时,___________ (填“有”或“无”)Mg(OH)2沉淀析出。(忽略反应过程中溶液的体积变化)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。请根据所学知识回答下列问题:
(1)0.1mol/L的 溶液中有关微粒浓度由大到小的顺序为
溶液中有关微粒浓度由大到小的顺序为
 ,则该溶液呈
,则该溶液呈___________ (填“酸性”“中性”或“碱性”),理由是___________ 。
(2)实验室配制 溶液时,需将
溶液时,需将 溶解在较浓盐酸中,然后加水稀释,这样操作的目的是
溶解在较浓盐酸中,然后加水稀释,这样操作的目的是___________ 。
(3)25℃时,将pH=11的氢氧化钠溶液 L与pH=1的稀硫酸
L与pH=1的稀硫酸 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则
L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则
___________ 。
(4)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水 ②0.1mol/L盐酸 ③0.1mol/L氯化镁溶液 ④0.1mol/L硝酸银溶液中,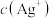 由大到小的顺序为
由大到小的顺序为___________ (填序号)。
(5)已知: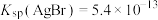 ,
, ,向
,向 溶液中加入
溶液中加入 和KBr,当两种沉淀共存时,
和KBr,当两种沉淀共存时,
___________ 。
(1)0.1mol/L的
 溶液中有关微粒浓度由大到小的顺序为
溶液中有关微粒浓度由大到小的顺序为
 ,则该溶液呈
,则该溶液呈(2)实验室配制
 溶液时,需将
溶液时,需将 溶解在较浓盐酸中,然后加水稀释,这样操作的目的是
溶解在较浓盐酸中,然后加水稀释,这样操作的目的是(3)25℃时,将pH=11的氢氧化钠溶液
 L与pH=1的稀硫酸
L与pH=1的稀硫酸 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则
L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则
(4)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水 ②0.1mol/L盐酸 ③0.1mol/L氯化镁溶液 ④0.1mol/L硝酸银溶液中,
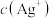 由大到小的顺序为
由大到小的顺序为(5)已知:
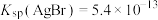 ,
, ,向
,向 溶液中加入
溶液中加入 和KBr,当两种沉淀共存时,
和KBr,当两种沉淀共存时,
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】现有如下物质:①石墨② 溶液③稀盐酸④铜⑤
溶液③稀盐酸④铜⑤ 溶液⑥
溶液⑥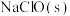 ⑦
⑦ 。请回答下列问题:
。请回答下列问题:
(1)能导电的是_______ (填序号,下同),属于电解质的是_______ 。
(2)NaClO溶液呈碱性,请用离子方程式表示该溶液呈碱性的原因:_______ 。
(3)若向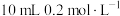 溶液②中逐滴滴加
溶液②中逐滴滴加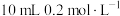 溶液③,实验过程中的现象为
溶液③,实验过程中的现象为_______ ;溶液②中离子浓度由大到小的顺序为_______ 。
(4)已知 ,向
,向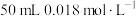 溶液⑤中加入等体积
溶液⑤中加入等体积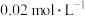 溶液③,混合后溶液中的
溶液③,混合后溶液中的
_______  。(设混合后溶液的体积为原两溶液体积之和)
。(设混合后溶液的体积为原两溶液体积之和)
 溶液③稀盐酸④铜⑤
溶液③稀盐酸④铜⑤ 溶液⑥
溶液⑥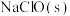 ⑦
⑦ 。请回答下列问题:
。请回答下列问题:(1)能导电的是
(2)NaClO溶液呈碱性,请用离子方程式表示该溶液呈碱性的原因:
(3)若向
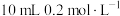 溶液②中逐滴滴加
溶液②中逐滴滴加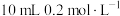 溶液③,实验过程中的现象为
溶液③,实验过程中的现象为(4)已知
 ,向
,向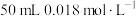 溶液⑤中加入等体积
溶液⑤中加入等体积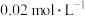 溶液③,混合后溶液中的
溶液③,混合后溶液中的
 。(设混合后溶液的体积为原两溶液体积之和)
。(设混合后溶液的体积为原两溶液体积之和)
您最近一年使用:0次



