某校化学课外兴趣小组的同学欲测定某品牌味精中食盐的含量。下面是该小组所进行的实验步骤:
①称取某品牌袋装味精样品10.0 g放入烧杯中,并加适量蒸馏水溶解;
②______________________________________ ;
③______________________________________ ;
④用蒸馏水洗涤沉淀2~3次;
⑤将沉淀烘干、称量,测得固体质量4.90 g。
根据上述实验步骤回答下列问题:
(1)请你在上面的空格内补齐所缺的实验步骤②、③。
(2)实验③所用的玻璃仪器有____________ 。
(3)检验沉淀是否洗净的方法是________________ 。
(4)若味精商标上标注:“谷氨酸钠含量≥80.0%,NaCl含量≤20.0%”,则此样品是否合格?________ (填“合格”或“不合格”)。
①称取某品牌袋装味精样品10.0 g放入烧杯中,并加适量蒸馏水溶解;
②
③
④用蒸馏水洗涤沉淀2~3次;
⑤将沉淀烘干、称量,测得固体质量4.90 g。
根据上述实验步骤回答下列问题:
(1)请你在上面的空格内补齐所缺的实验步骤②、③。
(2)实验③所用的玻璃仪器有
(3)检验沉淀是否洗净的方法是
(4)若味精商标上标注:“谷氨酸钠含量≥80.0%,NaCl含量≤20.0%”,则此样品是否合格?
更新时间:2018-12-04 10:06:07
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】碱式碳酸铜[xCuCO3·yCu(OH)2],呈孔雀绿颜色.又称为孔雀石,是一种名贵的矿物宝石。它与铜与空气中的氧气、二氧化碳和水蒸气等物质反应产生的物质。CuSO4溶液与Na2CO3溶液反应可以得到碱式碳酸铜,我们将对其组成进行相关探究。
[沉淀制备]称取12. 5 g胆矾(CuSO4• 5H2O)溶于87. 5mL蒸馏水中,滴加少量稀硫酸(体积可以忽略不计),充分搅拌后得到CuSO4溶液。向其中加入Na2CO3溶液,将所得蓝绿色悬浊液过滤,并用蒸馏水洗涤,再用无水乙醇洗涤,最后低温烘干备用。
[实验探究]我们设计了如下装置,用制得的蓝绿色固体进行实验。

根据以上实验回答下列问题
(1)配制硫酸铜溶液的过程中滴加稀硫酸的作用是_______________________________ ,
所得硫酸铜溶液的溶质质量分数为_____________________ 。
(2)实验室通常使用加热亚硝酸钠和氯化铵混合溶液的方法制取N2,该反应的化学方程为:__________________________________________________ 。
(3)D装置加热前,需要首先打开活塞K,通入适量N2,然后关闭K,再点燃D处酒精灯。
C中盛装的试剂应是___________ 。加热D后观察到的现象是_______________________ 。
(4)经查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用Ba(OH)2溶液代替澄清石灰水来定量测定蓝绿色固体的化学式,其原因是( )
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(5)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是_____________ 。若装置F中使用Ba(OH)2溶液,实验结束后经称量,装置E的质量增加0.27 g,F中产生沉淀1.97 g。则该蓝绿色固体的化学式为_____________ 。[写成xCuCO3·yCu(OH)2的形式]
[沉淀制备]称取12. 5 g胆矾(CuSO4• 5H2O)溶于87. 5mL蒸馏水中,滴加少量稀硫酸(体积可以忽略不计),充分搅拌后得到CuSO4溶液。向其中加入Na2CO3溶液,将所得蓝绿色悬浊液过滤,并用蒸馏水洗涤,再用无水乙醇洗涤,最后低温烘干备用。
[实验探究]我们设计了如下装置,用制得的蓝绿色固体进行实验。

根据以上实验回答下列问题
(1)配制硫酸铜溶液的过程中滴加稀硫酸的作用是
所得硫酸铜溶液的溶质质量分数为
(2)实验室通常使用加热亚硝酸钠和氯化铵混合溶液的方法制取N2,该反应的化学方程为:
(3)D装置加热前,需要首先打开活塞K,通入适量N2,然后关闭K,再点燃D处酒精灯。
C中盛装的试剂应是
(4)经查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用Ba(OH)2溶液代替澄清石灰水来定量测定蓝绿色固体的化学式,其原因是
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(5)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某铁矿石的主要成分是氧化铁,还含有少量的二氧化硅。实验室测定铁矿石样品中的铁含量时,首先对铁矿石进行预处理,其过程如图所示:

已知:①溶液D中只有Fe2+和钨蓝(H0.5WO3)能将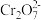 还原为Cr3+。
还原为Cr3+。
②加入少量稀K2Cr2O7溶液时,Fe2+不反应。
将溶液E稀释至100.00mL,取出25.00mL,加3mL硫酸-磷酸混合酸,再加4~5滴二苯胺磺酸钠指示剂,立即用0.1000mol•L-1K2Cr2O7标准溶液滴定至溶液呈稳定的蓝紫色即为终点,平行测定3次,平均消耗K2Cr2O7溶液的体积为12.50mL。
(1)该铁矿石样品与足量盐酸反应的离子方程式为____________ ,Na2WO4中钨元素的化合价为____ 。
(2)溶液D中加入少量的稀K2Cr2O7溶液后,发生反应的离子方程式为____________ 。
(3)用250mL容量瓶配制0.1000mol•L-1K2Cr2O7标准溶液时,用电子天平准确称取K2Cr2O7固体的质量为_______________ (保留到小数点后3位),还需要用到的主要玻璃仪器有_________ 。
(4)铁矿石样品中铁元素的质量分数为_________________ 。
(5)预处理所得溶液E放置时间过久,对测定结果的影响是____________ (填“偏高”“偏低”“无影响”)。

已知:①溶液D中只有Fe2+和钨蓝(H0.5WO3)能将
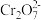 还原为Cr3+。
还原为Cr3+。②加入少量稀K2Cr2O7溶液时,Fe2+不反应。
将溶液E稀释至100.00mL,取出25.00mL,加3mL硫酸-磷酸混合酸,再加4~5滴二苯胺磺酸钠指示剂,立即用0.1000mol•L-1K2Cr2O7标准溶液滴定至溶液呈稳定的蓝紫色即为终点,平行测定3次,平均消耗K2Cr2O7溶液的体积为12.50mL。
(1)该铁矿石样品与足量盐酸反应的离子方程式为
(2)溶液D中加入少量的稀K2Cr2O7溶液后,发生反应的离子方程式为
(3)用250mL容量瓶配制0.1000mol•L-1K2Cr2O7标准溶液时,用电子天平准确称取K2Cr2O7固体的质量为
(4)铁矿石样品中铁元素的质量分数为
(5)预处理所得溶液E放置时间过久,对测定结果的影响是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:请回答下列问题:

(1)实验中碾碎药片需要的仪器是___________ 。
A.烧杯 B.研钵 C.坩埚
(2)证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加___________ 。
(3)步骤②加入过量H2O2的目的:___________ 。
(4)步骤②中反应的离子方程式:___________ 。
(5)步骤④中一系列处理的操作步骤:过滤、___________ 、灼烧、冷却、称量。
(6)若实验无损耗,则每片补血剂含铁元素的质量___________ g。

(1)实验中碾碎药片需要的仪器是
A.烧杯 B.研钵 C.坩埚
(2)证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加
(3)步骤②加入过量H2O2的目的:
(4)步骤②中反应的离子方程式:
(5)步骤④中一系列处理的操作步骤:过滤、
(6)若实验无损耗,则每片补血剂含铁元素的质量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】SO2是常见的硫氧化物,在化工、生活等领域中应用广泛。
I如图是实验室制取SO2并验证SO2某些性质的装置图

(1)⑥中发生反应的化学方程式为_________________________________
(2)③中实验现象为_____________________________________ ,证明SO2有____ 性
(3)⑤中离子反应方程式为______________________
II某学生对SO2与漂粉精的反应进行实验探究:
(1)pH试纸颜色的变化说明漂粉精溶液具有的性质是_________________
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是_______________________________________________
②由实验a、b不能判断白雾中含有HCl,理由是_______________________________________
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀盐酸,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀,则沉淀X中含有的物质是___________
②用离子方程式解释现象iii中黄绿色褪去的原因___________________________
I如图是实验室制取SO2并验证SO2某些性质的装置图

(1)⑥中发生反应的化学方程式为
(2)③中实验现象为
(3)⑤中离子反应方程式为
II某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精的pH | pH试纸先变蓝(约为12),后褪色 |
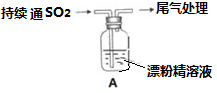 | i.液面上方出现白雾 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是
②由实验a、b不能判断白雾中含有HCl,理由是
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀盐酸,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀,则沉淀X中含有的物质是
②用离子方程式解释现象iii中黄绿色褪去的原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
【方案一】
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验步骤〗
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥_______ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将_______ (填“偏高”、“偏低”或“无影响”)。
【方案二】
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
〖问题讨论〗
(1)同学们拟选用下列实验装置完成实验:_______ 。
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因_______ 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是_______ 。
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与液体的凹面相平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。_______ 。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_______ mL。
【方案一】
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验步骤〗
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
【方案二】
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
〖问题讨论〗
(1)同学们拟选用下列实验装置完成实验:

②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与液体的凹面相平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
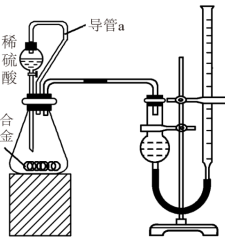
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略)在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水。实验现象:试管①中加热一段时间后,可以看到试管内液体沸腾;试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去。根据实验现象回答下列问题:
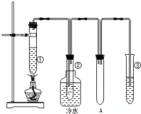
(1)装置A的作用是________
(2)试管①中发生的主要反应有:C8H18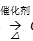 C4H10+C4H8 C8H36
C4H10+C4H8 C8H36 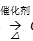 C8H18+C9H18丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为
C8H18+C9H18丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为________ 和________ ,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于________ 反应。其可能结构为________ (填字母,答案可能不止一个,下同)
A. B.
B.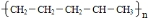
C.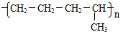 D.
D.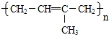
(3)写出试管③中反应的任意一个化学方程式________________ 。
(4)试管②中的少量液体的组成是________ (填序号)
①甲烷 ②乙烯 ③液态烷烃 ④液态烯烃。

(1)装置A的作用是
(2)试管①中发生的主要反应有:C8H18
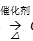 C4H10+C4H8 C8H36
C4H10+C4H8 C8H36 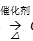 C8H18+C9H18丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为
C8H18+C9H18丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为A.
 B.
B.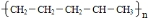
C.
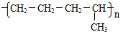 D.
D.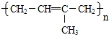
(3)写出试管③中反应的任意一个化学方程式
(4)试管②中的少量液体的组成是
①甲烷 ②乙烯 ③液态烷烃 ④液态烯烃。
您最近一年使用:0次



