实验室常用的某盐酸试剂瓶的标签上的有关数据如下图,试根据标签上的有关数据进行计算:
(1)计算该浓盐酸中HCl的物质的量浓度为_____________ 。
(2)计算欲配制480mL 0.20mol/L的稀盐酸溶液,需要取上述浓盐酸的体积为_____________ 。
(3)实验室用上述浓盐酸与二氧化锰反应制取氯气,若制得0.56L(标准状况)氯气,计算被氧化的HCl的物质的量为_____________ ,转移电子的物质的量为_____________ 。
盐酸 分子式:  相对分子质量 : 36.5 密度 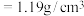  的质量分数: 的质量分数: 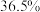 |
(1)计算该浓盐酸中HCl的物质的量浓度为
(2)计算欲配制480mL 0.20mol/L的稀盐酸溶液,需要取上述浓盐酸的体积为
(3)实验室用上述浓盐酸与二氧化锰反应制取氯气,若制得0.56L(标准状况)氯气,计算被氧化的HCl的物质的量为
11-12高三上·陕西西安·阶段练习 查看更多[1]
(已下线)2012届陕西省西安市华清中学高三上学期第一次月考化学试卷
更新时间:2016-12-09 02:04:24
|
相似题推荐
【推荐1】将12.8g铜与一定量的浓硝酸发生反应,铜反应完时,得到NO、NO2混合气体5.6L(标准状况下)。计算:
(1)反应过程中共转移电子__ NA;
(2)反应消耗硝酸的物质的量__ (写出计算过程)。
(1)反应过程中共转移电子
(2)反应消耗硝酸的物质的量
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】将54.8gNa2CO3和NaHCO3的混合物平均分成等量的两份,一份溶于水后加入足量某浓度的盐酸,收集到气体VL(标准状况下测定)。另一份直接加热至恒重,固体质量减轻了6.2克。试计算:
(1)原混合固体中Na2CO3和NaHCO3的物质的量之比:n(Na2CO3):n(NaHCO3)=__ 。
(2)V=___ L。
(3)若将54.8g原固体混合物溶于水,加入足量澄清石灰水,最终产生沉淀__ 克?
(1)原混合固体中Na2CO3和NaHCO3的物质的量之比:n(Na2CO3):n(NaHCO3)=
(2)V=
(3)若将54.8g原固体混合物溶于水,加入足量澄清石灰水,最终产生沉淀
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】下表为某市售盐酸试剂瓶标签上的部分信息。
(1)该盐酸的物质的量浓度为________ 。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中c(HCl)=________ 。
(3)取稀释后的该500 mL盐酸与足量的锌粒作用,生成标准状况下气体的体积是__________ 。
| 盐酸 分子式:HCl 相对分子质量:36.5 外观合格 密度约1.18 g/mL HCl的质量分数:36.5% 符合GB662−89 试剂生产许可证编号×× |
(1)该盐酸的物质的量浓度为
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中c(HCl)=
(3)取稀释后的该500 mL盐酸与足量的锌粒作用,生成标准状况下气体的体积是
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)标准状况下,2.24LCl2的质量为__ g;标准状况下,将aLHCl气体溶于水配成500mL0.4mol•L-1的溶液,则a=__ 。
(2)在无土栽培中,1L营养液的标准配置为5mol/LNH4Cl、1.6mol/LKCl、2.4mol/LK2SO4,若改用KCl、NH4Cl、(NH4)2SO4配制1L营养液,则NH4Cl的物质的量浓度为__ 。
(3)标准状况下,mg气体A和ng气体B具有相等的体积,则同温同压下A、B的密度之比为__ ,同质量的A、B的分子数目之比为__ 。
(4)在标准状况下,由CO和CO2组成的混合气体11.2L,质量为20g,该混合气体中,CO和CO2物质的量之比为___ ,碳与氧两种原子的数目之比为__ 。
(1)标准状况下,2.24LCl2的质量为
(2)在无土栽培中,1L营养液的标准配置为5mol/LNH4Cl、1.6mol/LKCl、2.4mol/LK2SO4,若改用KCl、NH4Cl、(NH4)2SO4配制1L营养液,则NH4Cl的物质的量浓度为
(3)标准状况下,mg气体A和ng气体B具有相等的体积,则同温同压下A、B的密度之比为
(4)在标准状况下,由CO和CO2组成的混合气体11.2L,质量为20g,该混合气体中,CO和CO2物质的量之比为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】称取一定量Fe2O3与Cu2O的混合粉末,用足量CO还原后,质量减轻8g。若原混合粉末用1L1mol∙L-1的稀H2SO4充分反应后,剩余固体质量为6.4g。已知:Cu2O+2H+=Cu+Cu2++H2O
(1)反应后硫酸的物质的量浓度为___ (设溶液体积不变)。
(2)原红色固体粉末中Fe2O3的物质的量为___ 。
(1)反应后硫酸的物质的量浓度为
(2)原红色固体粉末中Fe2O3的物质的量为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】现将芒硝(化学式为Na2SO4·10H2O)48.3 g配成2 L溶液,求该溶液中Na2SO4的物质的量浓度____________ 。
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】将含H2SO4 49 g的一定量的浓硫酸缓慢地加入水中,冷却至室温后,恰好得到稀硫酸1000mL。求:
(1)所得稀硫酸溶液中含H2SO4的物质的量是_____________ ?
(2)所得稀硫酸溶液中H+的物质的量浓度是________________ ?
(1)所得稀硫酸溶液中含H2SO4的物质的量是
(2)所得稀硫酸溶液中H+的物质的量浓度是
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】实验室用8.7g的MnO2与足量的浓盐酸制取氯气:求生成氯气的体积(标准状况)和被氧化的HCl的物质的量。
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】实验室常用加热高锰酸钾的方法制取少量氧气。
(1)现在欲制取标准状况下1.12L氧气,需要消耗高锰酸钾________ g;
(2)反应产生的MnO2经分离出来,与足量浓盐酸反应,其中被氧化的HCl的物质的量是________ 。
(1)现在欲制取标准状况下1.12L氧气,需要消耗高锰酸钾
(2)反应产生的MnO2经分离出来,与足量浓盐酸反应,其中被氧化的HCl的物质的量是
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐3】完成下列小题
(1)碳的氧化物可用来制备碳酰肼[ ,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式
,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式_____ 。
(2)控制城市空气污染源的方法可以有_____(多选)
(3) 有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:
有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现: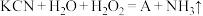 ,则生成物A的化学式为
,则生成物A的化学式为_____ 。
(4)实验室制备氯气时,高锰酸钾也是常用的强氧化剂。在酸性条件下, 离子被还原成
离子被还原成 。高锰酸钾与浓盐酸在室温下制氯气的离子方程式
。高锰酸钾与浓盐酸在室温下制氯气的离子方程式_____ 。
(5) 是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备
是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备 的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌,反应后的溶液中检验出氯离子。在此制备
的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌,反应后的溶液中检验出氯离子。在此制备 反应的离子方程式为
反应的离子方程式为_____ 。
(6)取100mL某钛液,加铝粉,使其发生反应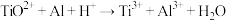 (未配平),反应完全后,消耗铝粉1.08g,则该钛液中
(未配平),反应完全后,消耗铝粉1.08g,则该钛液中 的物质的量浓度为
的物质的量浓度为_____ 。
(7)工业上利用纳米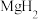 和
和 组成的体系储放氢(如图所示)。写出放氢过程中发生反应的化学方程式:
组成的体系储放氢(如图所示)。写出放氢过程中发生反应的化学方程式:_____ 。

(1)碳的氧化物可用来制备碳酰肼[
 ,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式
,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式(2)控制城市空气污染源的方法可以有_____(多选)
| A.开发新能源 | B.使用电动车 | C.植树造林 | D.戴上呼吸面具 |
(3)
 有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:
有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现: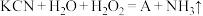 ,则生成物A的化学式为
,则生成物A的化学式为(4)实验室制备氯气时,高锰酸钾也是常用的强氧化剂。在酸性条件下,
 离子被还原成
离子被还原成 。高锰酸钾与浓盐酸在室温下制氯气的离子方程式
。高锰酸钾与浓盐酸在室温下制氯气的离子方程式(5)
 是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备
是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备 的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌,反应后的溶液中检验出氯离子。在此制备
的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌,反应后的溶液中检验出氯离子。在此制备 反应的离子方程式为
反应的离子方程式为(6)取100mL某钛液,加铝粉,使其发生反应
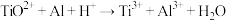 (未配平),反应完全后,消耗铝粉1.08g,则该钛液中
(未配平),反应完全后,消耗铝粉1.08g,则该钛液中 的物质的量浓度为
的物质的量浓度为(7)工业上利用纳米
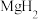 和
和 组成的体系储放氢(如图所示)。写出放氢过程中发生反应的化学方程式:
组成的体系储放氢(如图所示)。写出放氢过程中发生反应的化学方程式:
您最近一年使用:0次



