已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,下列各反应热关系中不正确的是( )
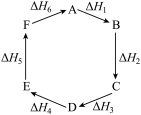

| A.A→F ΔH=-ΔH6 |
| B.A→D ΔH=ΔH1+ΔH2+ΔH3 |
| C.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0 |
| D.ΔH1+ΔH6=ΔH2+ΔH3+ΔH4+ΔH5 |
12-13高二上·陕西西安·期中 查看更多[11]
云南省丽江市第一高级中学2021-2022学年高二上学期元月考化学试题福建省福州高级中学2021-2022学年高二上学期期末化学考试题辽宁省大连市第一中学2021-2022学年高二上学期学情反馈(一)化学试题(已下线)第01章 化学反应的热效应(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)山西省太原市第五中学2019-2020学年高二上学期11月月考化学试题(理)(已下线)2019年8月30日 《每日一题》人教选修4——盖斯定律的应用福建省泉州市泉港区第一中学2018-2019学年高二上学期期末考试化学试题新疆维吾尔自治区沙雅县第二中学2018-2019学年高二上学期期中考试化学试题(已下线)2011-2012学年陕西省西安市第一中学高二上学期期中考试化学试卷2015-2016学年广东省清远市高二上学期期末考试化学试卷(已下线)2011-2012学年甘肃兰州一中高二上学期期末考试化学试卷
更新时间:2019-02-20 13:20:42
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】下列说法不正确 的是
| A.增大NH4Cl溶液的浓度,其水的离子积常数和pH均减小 |
| B.盖斯定律表明,一个化学反应的焓变仅与始态和终态有关,与途径无关 |
| C.新能源一般应具有资源丰富、可再生、无污染或少污染等特点 |
| D.工业上在选择合成氨的条件时,不仅要寻找以较高的反应速率获得适当平衡转化率的反应条件,还要考虑原料的价格,氮气、氢气的循环使用,反应热的综合利用等问题 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】化学反应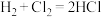 的能量变化如图所示,下列说法错误的是
的能量变化如图所示,下列说法错误的是
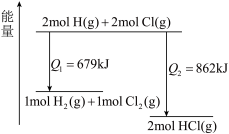
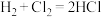 的能量变化如图所示,下列说法错误的是
的能量变化如图所示,下列说法错误的是
| A.该反应在光照和点燃条件下的反应热效应是相同的 |
B.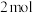 气态氢原子的能量低于 气态氢原子的能量低于 氢气的能量 氢气的能量 |
C. 与 与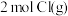 形成 形成 时释放 时释放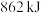 能量 能量 |
D.该反应的热化学反应方程式: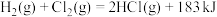 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】下列说法不正确的是
| A.已知冰的熔化热为 6.0kJ·mol-1,冰中氢键键能为 20 kJ·mol-1,若熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15 %的氢键 |
| B.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1 ,则该反应正反应活化能比逆反应活化能大100 kJ·mol-1 |
| C.甲烷的标准燃烧热为890.3 kJ·mol-1,则 1molCH4 发生反应CH4(g)+2O2(g)=CO2 (g) + 2H2O (g) 放出的热量小于 890.3 kJ·mol-1 |
D.500 ℃、30 MPa 下,将 0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成 NH3 (g),放出量热 19.3 kJ,其热化学方程式可表示为:N2(g)+3H2(g)  2NH3(g) ΔH=-38.6 kJ·mol-1 2NH3(g) ΔH=-38.6 kJ·mol-1 |
您最近半年使用:0次



