(1)已知①C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(g) △H1=akJ·mol-1;
②H2O(g)==H2O(1) △H2=bkJ·mol-1;
③C2H5OH(g)==C2H5OH(1) △H3=ckJ·mol-1,
写出 C2H5OH(1)完全燃烧生成CO2(g)和H2O(1)的热化学方程式__________________
(2)已知下列热化学方程式:
① H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH=______ kJ/moL
②H2O(g)==H2O(1) △H2=bkJ·mol-1;
③C2H5OH(g)==C2H5OH(1) △H3=ckJ·mol-1,
写出 C2H5OH(1)完全燃烧生成CO2(g)和H2O(1)的热化学方程式
(2)已知下列热化学方程式:
① H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH=
11-12高二上·福建·期中 查看更多[1]
(已下线)2011-2012学年福建省福建师大附中高二上学期期中考试化学试卷
更新时间:2011-11-23 12:12:54
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】氮和硫的化合物在生产生活中广泛存在。研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.(1)已知:
2CO(g)+O2(g) 2CO2(g) △H1=﹣566.00kJ•mol-1
2CO2(g) △H1=﹣566.00kJ•mol-1
2SO2(g)+O2(g) 2SO3(g) △H2=﹣196.6kJ•mol-1
2SO3(g) △H2=﹣196.6kJ•mol-1
2NO(g)+O2(g) 2NO2(g) △H3=﹣113.0kJ•mol-1
2NO2(g) △H3=﹣113.0kJ•mol-1
则反应2NO2(g)+SO2(g)+ CO(g) SO3(g)+2NO(g)+ CO2(g)的△H=
SO3(g)+2NO(g)+ CO2(g)的△H=_________ kJ•mol-1。
(2)NOx主要来源于汽车尾气。T℃时,模拟汽车尾气催化转化:2NO+2CO 2CO2+N2,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示:
2CO2+N2,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示:
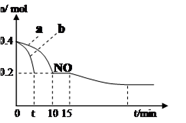
①T℃时该化学反应的平衡常数K=____ ;
②图中a、b分别表示使用同种催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是____ (填“a”或“b”)。
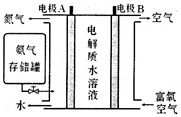
Ⅱ.科学家发明了NH3燃料电池,以KOH为电解质,原理如图所示。该燃料电池的负极反应式为__________________ 。
Ⅲ.SO2主要来源于煤的燃烧。
25℃时,电离平衡常数:
回答下列问题:
(1)常温下,pH相同的下列溶液:①Na2CO3、②NaHCO3、③Na2SO3。物质的量浓度由大到小的排列顺序为___________ >___________ >___________ 。(用序号表示)
(2)已知NaHSO3溶液显酸性,下列说法正确的是_________________ 。
A. c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
B. c(Na+)+c(H+)=c(OH-)+c(HSO3-)+c(SO32-)
C. c(HSO3-)> c(H+)> c(H2SO3)> c(SO32-)
D. c(H+)+c(H2SO3)=c(SO32-)+c(OH-)
Ⅰ.(1)已知:
2CO(g)+O2(g)
 2CO2(g) △H1=﹣566.00kJ•mol-1
2CO2(g) △H1=﹣566.00kJ•mol-12SO2(g)+O2(g)
 2SO3(g) △H2=﹣196.6kJ•mol-1
2SO3(g) △H2=﹣196.6kJ•mol-12NO(g)+O2(g)
 2NO2(g) △H3=﹣113.0kJ•mol-1
2NO2(g) △H3=﹣113.0kJ•mol-1则反应2NO2(g)+SO2(g)+ CO(g)
 SO3(g)+2NO(g)+ CO2(g)的△H=
SO3(g)+2NO(g)+ CO2(g)的△H=(2)NOx主要来源于汽车尾气。T℃时,模拟汽车尾气催化转化:2NO+2CO
 2CO2+N2,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示:
2CO2+N2,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示: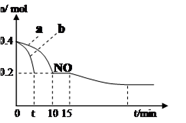
①T℃时该化学反应的平衡常数K=
②图中a、b分别表示使用同种催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是
Ⅱ.科学家发明了NH3燃料电池,以KOH为电解质,原理如图所示。该燃料电池的负极反应式为

Ⅲ.SO2主要来源于煤的燃烧。
25℃时,电离平衡常数:
| 化学式 | H2CO3 | H2SO3 |
| 电离平衡常数 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
回答下列问题:
(1)常温下,pH相同的下列溶液:①Na2CO3、②NaHCO3、③Na2SO3。物质的量浓度由大到小的排列顺序为
(2)已知NaHSO3溶液显酸性,下列说法正确的是
A. c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
B. c(Na+)+c(H+)=c(OH-)+c(HSO3-)+c(SO32-)
C. c(HSO3-)> c(H+)> c(H2SO3)> c(SO32-)
D. c(H+)+c(H2SO3)=c(SO32-)+c(OH-)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
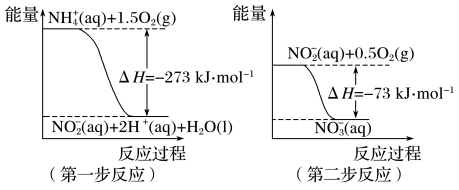
①第一步反应是______________ (填“放热”或“吸热”)反应,判断依据是___________ 。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________ 。
(2)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1________ ΔH2(填“>”、“<”或“=”)。
(3)在298 K、101 kPa时,已知:①2H2O(g)=O2(g)+2H2(g) ΔH1;②Cl2(g)+H2(g)=2HCl(g) ΔH2;③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3,则ΔH3与ΔH1和ΔH2之间的关系正确的是________ 。
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
(4)已知:
①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1②Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ·mol-1,则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为
O2(g) ΔH=-226 kJ·mol-1,则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为_____________ 。
(5)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
则表中a=________ 。

①第一步反应是
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是
(2)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1
(3)在298 K、101 kPa时,已知:①2H2O(g)=O2(g)+2H2(g) ΔH1;②Cl2(g)+H2(g)=2HCl(g) ΔH2;③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3,则ΔH3与ΔH1和ΔH2之间的关系正确的是
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
(4)已知:
①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1②Na2O2(s)+CO2(g)=Na2CO3(s)+
 O2(g) ΔH=-226 kJ·mol-1,则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为
O2(g) ΔH=-226 kJ·mol-1,则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为(5)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断 裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】化学反应产生的各种形式的能量是人类社会所需能量的重要来源,研究化学反应的能量变化具有重要意义。根据要求,回答下列问题:
Ⅰ.实验室用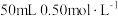 盐酸、
盐酸、 溶液进行测定中和反应反应热(
溶液进行测定中和反应反应热( )的实验,实验装置如图所示,得到的数据如表所示。
)的实验,实验装置如图所示,得到的数据如表所示。
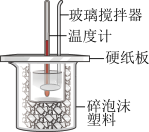
回答下列问题:
(1)实验时,___________ (填“能”或“不能”)用铜丝搅拌棒代替玻璃搅拌器,其理由是___________ 。
(2)已知:反应后溶液的比热容c为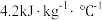 ,各溶液的密度均为
,各溶液的密度均为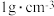 。
。
①根据实验结果计算出 溶液与
溶液与 溶液反应生成
溶液反应生成 水的反应热
水的反应热
___________  。
。
②若实验过程中,未加盖硬纸板,则 将
将___________ (填“偏大”、“偏小”或“无影响”,下同)。
③若用浓硫酸代替 做实验,则
做实验,则 将
将___________ 。
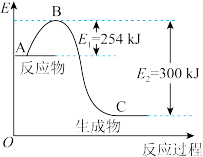
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(3) 和
和 反应生成
反应生成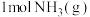 的过程中能量的变化如图,请写出
的过程中能量的变化如图,请写出 和
和 反应生成
反应生成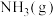 的热化学方程式:
的热化学方程式:___________ 。
(4)用 催化还原
催化还原 ,可以消除氮氧化物的污染。已知:
,可以消除氮氧化物的污染。已知:
①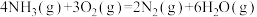
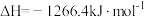
②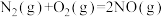
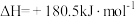
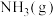 还原
还原 生成
生成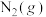 和
和 ,每消耗
,每消耗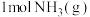 时,该反应过程
时,该反应过程___________ (填“吸收”或“放出”)___________  的热量。
的热量。
Ⅰ.实验室用
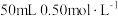 盐酸、
盐酸、 溶液进行测定中和反应反应热(
溶液进行测定中和反应反应热( )的实验,实验装置如图所示,得到的数据如表所示。
)的实验,实验装置如图所示,得到的数据如表所示。
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.1 | 20.3 | 23.6 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 20.5 | 20.6 | 24.9 |
(1)实验时,
(2)已知:反应后溶液的比热容c为
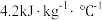 ,各溶液的密度均为
,各溶液的密度均为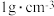 。
。①根据实验结果计算出
 溶液与
溶液与 溶液反应生成
溶液反应生成 水的反应热
水的反应热
 。
。②若实验过程中,未加盖硬纸板,则
 将
将③若用浓硫酸代替
 做实验,则
做实验,则 将
将Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(3)
 和
和 反应生成
反应生成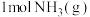 的过程中能量的变化如图,请写出
的过程中能量的变化如图,请写出 和
和 反应生成
反应生成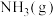 的热化学方程式:
的热化学方程式:
(4)用
 催化还原
催化还原 ,可以消除氮氧化物的污染。已知:
,可以消除氮氧化物的污染。已知:①
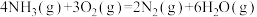
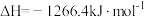
②
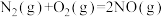
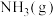 还原
还原 生成
生成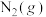 和
和 ,每消耗
,每消耗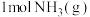 时,该反应过程
时,该反应过程 的热量。
的热量。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】汽车尾气中主要污染物是 和CO,它们是现代化城市中的重要大气污染物。
和CO,它们是现代化城市中的重要大气污染物。
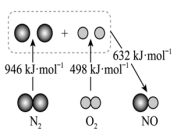
(1)汽车发动机工作时会引发 和
和 反应生成NO,其能量变化如图所示,则图中三种分子最稳定的是
反应生成NO,其能量变化如图所示,则图中三种分子最稳定的是___________ ,图中对应反应的热化学方程式为___________ 。
(2) 和CO均是有害气体,可在
和CO均是有害气体,可在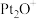 表面转化为无害气体,其反应原理如下:
表面转化为无害气体,其反应原理如下: 。有关化学反应的能量变化过程如图所示。
。有关化学反应的能量变化过程如图所示。
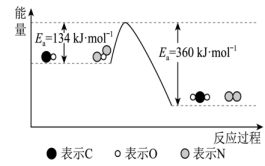
图中反应是___________ (填“放热”或“吸热”)反应,该反应的活化能为___________ ,该反应的 =
=___________ 。
(3)利用 还原法可将
还原法可将 ,还原为
,还原为 进行脱除。已知:
进行脱除。已知: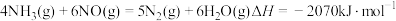 ,若有0.5molNO被还原,放出的热量为
,若有0.5molNO被还原,放出的热量为___________ 。
 和CO,它们是现代化城市中的重要大气污染物。
和CO,它们是现代化城市中的重要大气污染物。(1)汽车发动机工作时会引发
 和
和 反应生成NO,其能量变化如图所示,则图中三种分子最稳定的是
反应生成NO,其能量变化如图所示,则图中三种分子最稳定的是
(2)
 和CO均是有害气体,可在
和CO均是有害气体,可在 表面转化为无害气体,其反应原理如下:
表面转化为无害气体,其反应原理如下: 。有关化学反应的能量变化过程如图所示。
。有关化学反应的能量变化过程如图所示。
图中反应是
 =
=(3)利用
 还原法可将
还原法可将 ,还原为
,还原为 进行脱除。已知:
进行脱除。已知: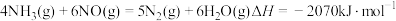 ,若有0.5molNO被还原,放出的热量为
,若有0.5molNO被还原,放出的热量为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】下图是工业生产硝酸铵的流程。
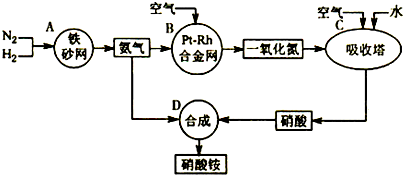
(1)吸收塔C中通入空气的目的是_________________________________ 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是_______ (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H = -1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式:_______ ,氨催化氧化反应的化学平衡常数表达式K=_____ 。
(3)已知:N2(g)+3H2(g) 2NH3(g) △H= -92 kJ/mol。为提高氢气的转化率,宜采取的措施有
2NH3(g) △H= -92 kJ/mol。为提高氢气的转化率,宜采取的措施有_______ 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为________ 。

(1)吸收塔C中通入空气的目的是
A、B、C、D四个容器中的反应,属于氧化还原反应的是
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H = -1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式:
(3)已知:N2(g)+3H2(g)
 2NH3(g) △H= -92 kJ/mol。为提高氢气的转化率,宜采取的措施有
2NH3(g) △H= -92 kJ/mol。为提高氢气的转化率,宜采取的措施有A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】 是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:
是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为: 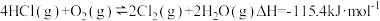 。该反应分两步进行,其基本原理如下图所示:
。该反应分两步进行,其基本原理如下图所示:
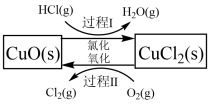
过程I的反应为,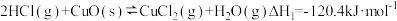
(])该原理中, 的作用是
的作用是_____________
(2)过程II反应的热化学方程式为____________
(3)压强为 时,地康法中
时,地康法中 的平衡转化率
的平衡转化率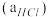 随温度变化曲线如图。
随温度变化曲线如图。
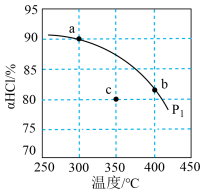
①平衡常数比较:K(a)____________ K(b)(填">“<"或“-").
②c点表示投料不变,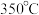 、压强为
、压强为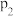 时,地康法中HCl的平衡转化率,则p2
时,地康法中HCl的平衡转化率,则p2_____________ p1(填“>”“<”或“=”),理由是___________ 。
 是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:
是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为: 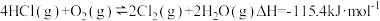 。该反应分两步进行,其基本原理如下图所示:
。该反应分两步进行,其基本原理如下图所示:
过程I的反应为,
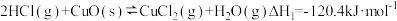
(])该原理中,
 的作用是
的作用是(2)过程II反应的热化学方程式为
(3)压强为
 时,地康法中
时,地康法中 的平衡转化率
的平衡转化率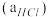 随温度变化曲线如图。
随温度变化曲线如图。
①平衡常数比较:K(a)
②c点表示投料不变,
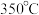 、压强为
、压强为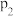 时,地康法中HCl的平衡转化率,则p2
时,地康法中HCl的平衡转化率,则p2
您最近一年使用:0次



