氢化钙(CaH2)是种白色细颗粒状固体,能与水发生剧烈反应,其反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,常用作登山运动员的能源提供剂。某化学实验小组为了探究氢化钙的性质,将一定量的CaH2加入到碳酸钠溶液中,立即产生大量气泡,且溶液变浑浊。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是____ (填写化学式)。
为进步确定滤液中所含溶质的成分,他们进行了以下实验探究。
【提出猜想】猜想一:NaOH 猜想二:NaOH和Na2CO3
猜想三:____________ 猜想四:NaOH、Na2CO3、Ca(OH)2
经过分析,大家一致认为上述猜想____ 不需要验证,肯定是错误的,原因是(用化学方程式表示):_____ 。
【实验探究】
方案一:取一定量的滤液于试管中,往其中滴加少量稀盐酸,无明显实验现象。
方案二:取一定量的滤液于另一试管中,往其中滴加氯化钡溶液,观察到有白色沉淀产生。
【讨论交流】根据实验现象,得出猜想____ 是正确的。请解释方案一中无明显现象的原因是____ 。
【拓展探究】上述小组同学将5g氢化钙样品(所含杂质不参与反应也不溶于水)加入到50g Na2CO3溶液中,充分恰好完全反应。实验测得反应过程中产生气体的质量为0.4g。计算:
(1)样品中CaH2的质量分数为_____ 。
(2)原Na2CO3溶液中溶质的质量为____ 。
(3)反应后溶液中溶质的质量分数为_____ 。(计算结果保留一位小数)
为进步确定滤液中所含溶质的成分,他们进行了以下实验探究。
【提出猜想】猜想一:NaOH 猜想二:NaOH和Na2CO3
猜想三:
经过分析,大家一致认为上述猜想
【实验探究】
方案一:取一定量的滤液于试管中,往其中滴加少量稀盐酸,无明显实验现象。
方案二:取一定量的滤液于另一试管中,往其中滴加氯化钡溶液,观察到有白色沉淀产生。
【讨论交流】根据实验现象,得出猜想
【拓展探究】上述小组同学将5g氢化钙样品(所含杂质不参与反应也不溶于水)加入到50g Na2CO3溶液中,充分恰好完全反应。实验测得反应过程中产生气体的质量为0.4g。计算:
(1)样品中CaH2的质量分数为
(2)原Na2CO3溶液中溶质的质量为
(3)反应后溶液中溶质的质量分数为
更新时间:2019-10-18 12:08:50
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
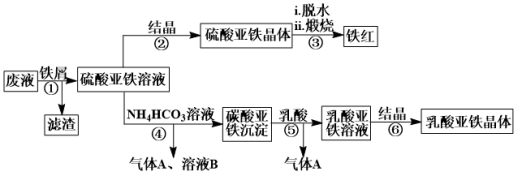
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO 。请回答:
。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是___________ 。
(2)滤渣的主要成分为TiO2•xH2O,写出TiOSO4水解生成TiO2•xH2O的化学方程式___________ 。
(3)写出硫酸亚铁在空气中煅烧生成铁红的反应的化学方程式___________ ,该反应中每产生1mol铁红(氧化铁),转移的电子数为___________ mol。
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因______
(5)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及___________ 。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)___________ 。 (已知MnO +5Fe2++8H+=Mn2++5Fe3++4H2O)
+5Fe2++8H+=Mn2++5Fe3++4H2O)

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO
 。请回答:
。请回答:(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是
(2)滤渣的主要成分为TiO2•xH2O,写出TiOSO4水解生成TiO2•xH2O的化学方程式
(3)写出硫酸亚铁在空气中煅烧生成铁红的反应的化学方程式
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因
(5)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)
 +5Fe2++8H+=Mn2++5Fe3++4H2O)
+5Fe2++8H+=Mn2++5Fe3++4H2O)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】乳酸亚铁晶体[CH3CH(OH)COO]2Fe·3H2O(M=288 g/mol)是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸CH3CH(OH)COOH与FeCO3反应制得.
I.制备碳酸亚铁
(1)利用如图所示装置进行实验。装置中仪器C的名称是____________ 。
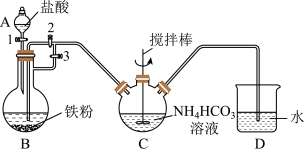
(2)实验开始时,首先关闭活塞2,打开活塞1、3,目的是________________________ ;关闭活塞1,反应一段时间后,关闭活塞_________ ,打开活塞___________ ,观察到B中溶液进入到C中,C中产生沉淀和气体。生成FeCO3的离子方程式为__________ 。
(3)装置D的作用是___________________ 。
Ⅱ.乳酸亚铁晶体的制备及纯度测定
将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸,从所得溶液中获得乳酸亚铁晶体。
(4)加入少量铁粉的作用是______________________________ 。
(5)用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其主要原因是____________________________________________ 。
(6)经查阅文献后,改用Ce(SO4)2标准溶液进行滴定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760 g样品,溶解后进行必要处理,用容量瓶配制成250 mL溶液,每次取25.00 mL,用0.1000 mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表所示:
则产品中乳酸亚铁晶体的纯度为________ %(保留小数点后两位)。
I.制备碳酸亚铁
(1)利用如图所示装置进行实验。装置中仪器C的名称是

(2)实验开始时,首先关闭活塞2,打开活塞1、3,目的是
(3)装置D的作用是
Ⅱ.乳酸亚铁晶体的制备及纯度测定
将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸,从所得溶液中获得乳酸亚铁晶体。
(4)加入少量铁粉的作用是
(5)用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其主要原因是
(6)经查阅文献后,改用Ce(SO4)2标准溶液进行滴定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760 g样品,溶解后进行必要处理,用容量瓶配制成250 mL溶液,每次取25.00 mL,用0.1000 mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表所示:
| 滴定次数 | 0.1000 mol L-1Ce(SO4)2/标准溶液体积/mL L-1Ce(SO4)2/标准溶液体积/mL | |
| 滴定前读数 | 滴定后读数 | |
| 1 | 0.20 | 19.65 |
| 2 | 0.22 | 21.42 |
| 3 | 1.15 | 20.70 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】氯化亚铜(CuCl)微溶于水,易被氧化,广泛应用于医药等行业。以废铜渣(铜单质的质量分数为64%,CuO的质量分数为8%,其他杂质不含铜元素)为原料制备CuCl流程如下:
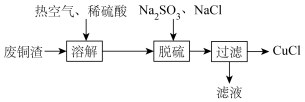
【资料】CuCl固体难溶于水,与Cl-反应生成可溶于水的离子[CuCl2]-。
(1)用Na2SO3固体配制100 mL0.50 mol/LNa2SO3溶液时,需要的玻璃仪器有烧杯、玻璃棒、胶体滴管、___________ (填仪器名称);
(2)“溶解”步骤装置如图所示。
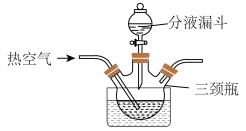
①“溶解”制备硫酸铜的化学程式为2Cu+2H2SO4+O2=2CuSO4+2H2O
___________ 。
②通入热空气的目的是___________ ;
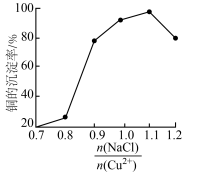
(3)“还原”过程中所得的氧化产物为___________ ,NaCl的用量对铜的沉淀率的影响如图所示。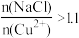 时,CuCl的沉淀率下降的原因是
时,CuCl的沉淀率下降的原因是___________ ;
(4)准确称取所制备的氯化亚铜样品0.50 g,将其置于过量的FeCl3溶液中,待样品完全溶解后过滤,将滤液及洗涤液一并转移到锥形瓶中,加入指示剂2滴,立刻滴入0.20 mol/LCe(SO4)2标准溶液,至恰好反应时,消耗Ce(SO4)2标准溶液20.00 mL。(已知:FeCl3+CuCl=FeCl2+CuCl2、Ce4++Fe2+=Ce3++Fe3+,且杂质不参与反应。)
①样品中CuCl的质量分数为___________ 。(写出计算过程)
②若操作过程缺少“将洗涤液一并转移到瓶中”的步骤,会导致CuCl的质量分数___________ (填“偏大”或“偏小”)。

【资料】CuCl固体难溶于水,与Cl-反应生成可溶于水的离子[CuCl2]-。
(1)用Na2SO3固体配制100 mL0.50 mol/LNa2SO3溶液时,需要的玻璃仪器有烧杯、玻璃棒、胶体滴管、
(2)“溶解”步骤装置如图所示。

①“溶解”制备硫酸铜的化学程式为2Cu+2H2SO4+O2=2CuSO4+2H2O

②通入热空气的目的是
(3)“还原”过程中所得的氧化产物为
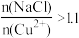 时,CuCl的沉淀率下降的原因是
时,CuCl的沉淀率下降的原因是
(4)准确称取所制备的氯化亚铜样品0.50 g,将其置于过量的FeCl3溶液中,待样品完全溶解后过滤,将滤液及洗涤液一并转移到锥形瓶中,加入指示剂2滴,立刻滴入0.20 mol/LCe(SO4)2标准溶液,至恰好反应时,消耗Ce(SO4)2标准溶液20.00 mL。(已知:FeCl3+CuCl=FeCl2+CuCl2、Ce4++Fe2+=Ce3++Fe3+,且杂质不参与反应。)
①样品中CuCl的质量分数为
②若操作过程缺少“将洗涤液一并转移到瓶中”的步骤,会导致CuCl的质量分数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】为了证明CO具有还原性,有人设计了如图所示的实验。
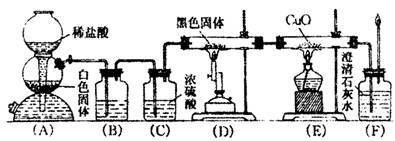
(1)装置B的最适宜的试剂是_____________ ;
(2)装置D中发生反应的化学方程式是___________ ;
(3)必须用装置C吸收除去气体中水蒸气的理由是___________ ;
(4)若根据F中石灰水变浑浊的现象也能确认CO具有还原性,应在下图中装置___________ 与___________ 之间连下图所示的___________ 装置(填序号)。
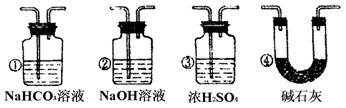

(1)装置B的最适宜的试剂是
(2)装置D中发生反应的化学方程式是
(3)必须用装置C吸收除去气体中水蒸气的理由是
(4)若根据F中石灰水变浑浊的现象也能确认CO具有还原性,应在下图中装置

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的圆底烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:
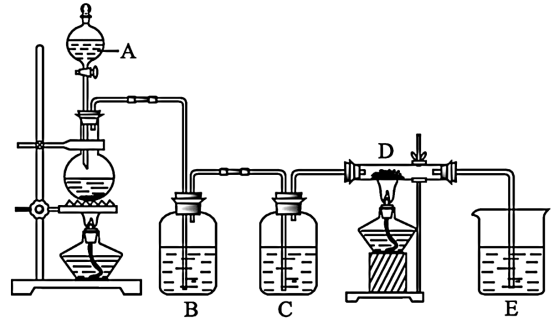
(1)仪器A的名称是____ ,圆底烧瓶中反应的化学方程式是____ 。
(2)气体通过装置B的目的是_____ 。
(3)D中反应的化学方程式是____ 。
(4)烧杯E中盛放的液体是____ ,反应的离子方程式是____ 。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应。为收集D中产物,在D与E之间,除增加收集装置外,还需要增加___ 装置。

(1)仪器A的名称是
(2)气体通过装置B的目的是
(3)D中反应的化学方程式是
(4)烧杯E中盛放的液体是
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应。为收集D中产物,在D与E之间,除增加收集装置外,还需要增加
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】氯水是一-种重要的化学试剂,在工业、生活中有着重要的应用。为探究氯水的成分和性质某实验小组进行了如下实验:
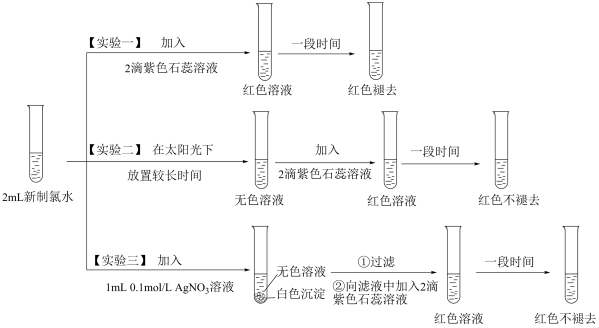
(一)根据以上实验填空
(1)氯水呈_______________ 色,说明其中含有________________ (填物质的电子式)。
(2)实验一的现象表明,氯水具有___________ 性和_____________ 性。
(3)氯气与水反应化学方程式为_______________________________ 。
(4)实验二中“红色不褪去”的相关物质分解的化学方程式为_________________ 。
(二)为了进一步探究实验三中“红色不褪去”的原因,实验小组又进行实验四和实验五
[实验四]
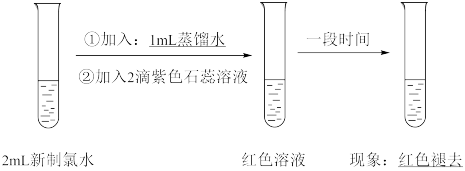
(5)实验四证明了实验三中“红色不褪去”不是因为_____________________ 。
[实验五]取实验三的白色沉淀,洗涤,用饱和氯化钠溶液浸泡,取上层清液,滴加2滴紫色石蕊溶液,一段时间后,颜色褪去。写出氯水和硝酸银溶液反应的化学方程式__________ 。

(一)根据以上实验填空
(1)氯水呈
(2)实验一的现象表明,氯水具有
(3)氯气与水反应化学方程式为
(4)实验二中“红色不褪去”的相关物质分解的化学方程式为
(二)为了进一步探究实验三中“红色不褪去”的原因,实验小组又进行实验四和实验五
[实验四]

(5)实验四证明了实验三中“红色不褪去”不是因为
[实验五]取实验三的白色沉淀,洗涤,用饱和氯化钠溶液浸泡,取上层清液,滴加2滴紫色石蕊溶液,一段时间后,颜色褪去。写出氯水和硝酸银溶液反应的化学方程式
您最近一年使用:0次



