固体化合物X由四种常见的元素组成,为探究其成分,某学生进行如下实验:
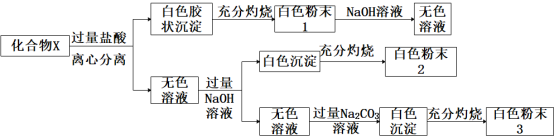
①20.8gX固体进行实验,得到白色粉末1质量12.0g,白色粉末2质量为6.0g;
②白色粉末2可用作耐高温材料,白色粉末3是一种常见干燥剂;请回答问题:
(1)X中金属元素的名称是______ 。
(2)化合物X与足量盐酸反应离子方程式______ 。
(3)在高温条件下,白色粉末2中某元素单质与白色粉末1反应,是工业制备另一种单质方法之一,写出该反应的化学方程式______ 。

①20.8gX固体进行实验,得到白色粉末1质量12.0g,白色粉末2质量为6.0g;
②白色粉末2可用作耐高温材料,白色粉末3是一种常见干燥剂;请回答问题:
(1)X中金属元素的名称是
(2)化合物X与足量盐酸反应离子方程式
(3)在高温条件下,白色粉末2中某元素单质与白色粉末1反应,是工业制备另一种单质方法之一,写出该反应的化学方程式
18-19高三·浙江·阶段练习 查看更多[1]
(已下线)【新东方】高中化学181
更新时间:2019-11-09 16:34:32
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下图是中学常见物质间的转化关系。已知:
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液若保存不当常呈黄色。

回答下列问题:
(1)A的电子式为_______ ;B分子属于_______ 分子(极性、非极性);
(2)反应①的化学方程式为_______ ,
反应②的离子方程式为_______ ,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为_______ L。
(4)检验K中阳离子常用的方法是_______ 。
(5)L浓溶液的保存方法是_______ 。
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液若保存不当常呈黄色。

回答下列问题:
(1)A的电子式为
(2)反应①的化学方程式为
反应②的离子方程式为
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为
(4)检验K中阳离子常用的方法是
(5)L浓溶液的保存方法是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】已知:A、B为常见的非金属单质且均为气体;甲、乙为短周期金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性。各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):

(1)写出反应②的化学方程式_______________ 。
(2)反应④中每消耗1 mol G,转移电子的物质的量为________ 。
(3)反应⑥的离子方程式是______________ 。
(4)写出工业冶炼金属乙的化学方程式________________ 。
(5)实验室中保存I的浓溶液的方法是______________ 。
(6)SiCl4与过量A在加热条件下反应可制得高纯硅,整个制备纯硅的过程中必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是_______________ ;H2还原SiCl4过程中若混入O2,可能引起的后果是________________ 。
(7)有一种常见金属丙,常温时只能溶于稀的I溶液,写出过量的此金属溶于稀I溶液的离子方程式___________ ,向此溶液中加入H溶液,现象为__________ 。

(1)写出反应②的化学方程式
(2)反应④中每消耗1 mol G,转移电子的物质的量为
(3)反应⑥的离子方程式是
(4)写出工业冶炼金属乙的化学方程式
(5)实验室中保存I的浓溶液的方法是
(6)SiCl4与过量A在加热条件下反应可制得高纯硅,整个制备纯硅的过程中必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是
(7)有一种常见金属丙,常温时只能溶于稀的I溶液,写出过量的此金属溶于稀I溶液的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂。

(1)物质C的化学式___________ ;物质B的电子式为___________
(2)写出反应的化学反应方程式:⑤___________
(3)写出反应的离子方程式:⑦___________
(4)Na2FeO4还可在碱性条件下,用NaClO氧化Fe(OH)3来制备,请书写离子方程式:____________ 。根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因___________ 。
(5)可用滴定分析法测定Na2FeO4的纯度,已知: FeO +CrO
+CrO +2H2O=CrO
+2H2O=CrO +Fe(OH)3+OH-;2CrO
+Fe(OH)3+OH-;2CrO +2H+=Cr2O
+2H+=Cr2O +H2O ; Cr2O
+H2O ; Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O。现称量2.28g高铁酸钠粗样品溶解,加入足量KCrO2充分反应后过滤,将滤液定容于250mL容量瓶,每次取25mL定容后的溶液,加入稀硫酸进行酸化,再用0.100mol/L的(NH4)2Fe(SO4)2标准溶液滴定三次,每次消耗标准液的体积分别为28.36mL、29.98mL、30.02mL。则:
+6Fe2++14H+=2Cr3++6Fe3++7H2O。现称量2.28g高铁酸钠粗样品溶解,加入足量KCrO2充分反应后过滤,将滤液定容于250mL容量瓶,每次取25mL定容后的溶液,加入稀硫酸进行酸化,再用0.100mol/L的(NH4)2Fe(SO4)2标准溶液滴定三次,每次消耗标准液的体积分别为28.36mL、29.98mL、30.02mL。则:
①上述样品中高铁酸钠的质量分数为___________ 。
② 若到达滴定终点时仰视读数,将导致所测定的样品质量分数___________ 。(偏大、偏小、不变)

(1)物质C的化学式
(2)写出反应的化学反应方程式:⑤
(3)写出反应的离子方程式:⑦
(4)Na2FeO4还可在碱性条件下,用NaClO氧化Fe(OH)3来制备,请书写离子方程式:
(5)可用滴定分析法测定Na2FeO4的纯度,已知: FeO
 +CrO
+CrO +2H2O=CrO
+2H2O=CrO +Fe(OH)3+OH-;2CrO
+Fe(OH)3+OH-;2CrO +2H+=Cr2O
+2H+=Cr2O +H2O ; Cr2O
+H2O ; Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O。现称量2.28g高铁酸钠粗样品溶解,加入足量KCrO2充分反应后过滤,将滤液定容于250mL容量瓶,每次取25mL定容后的溶液,加入稀硫酸进行酸化,再用0.100mol/L的(NH4)2Fe(SO4)2标准溶液滴定三次,每次消耗标准液的体积分别为28.36mL、29.98mL、30.02mL。则:
+6Fe2++14H+=2Cr3++6Fe3++7H2O。现称量2.28g高铁酸钠粗样品溶解,加入足量KCrO2充分反应后过滤,将滤液定容于250mL容量瓶,每次取25mL定容后的溶液,加入稀硫酸进行酸化,再用0.100mol/L的(NH4)2Fe(SO4)2标准溶液滴定三次,每次消耗标准液的体积分别为28.36mL、29.98mL、30.02mL。则:①上述样品中高铁酸钠的质量分数为
② 若到达滴定终点时仰视读数,将导致所测定的样品质量分数
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】含A元素的一种单质是一种重要的半导体材料,含 A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)A的原子结构示意图为________ ,A与碳在原子的电子层结构上的相同点是________________________________________________________ 。
(2)易与C发生化学反应的酸是_________ (写名称),反应的化学方程式是_______________________________ 。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D
①写出该反应的化学方程式:___________________________________________ 。
②要将纯碱高温熔化,下列坩埚中可选用的是________ 。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.铁坩埚
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是________ 。
(1)A的原子结构示意图为
(2)易与C发生化学反应的酸是
(3)将C与纯碱混合高温熔融时也发生化学反应生成D
①写出该反应的化学方程式:
②要将纯碱高温熔化,下列坩埚中可选用的是
A.普通玻璃坩埚 B.石英玻璃坩埚 C.铁坩埚
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】氮化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,但生产成本较高。不溶于酸(氢氟酸除外),高温下氧气及水蒸气能明显腐蚀氮化硅。一种用工业硅(含少量铁、铜的单质及氧化物)和 (含少量
(含少量 )合成氮化硅的工艺流程如下:
)合成氮化硅的工艺流程如下:

(1) 净化时,铜屑的作用是
净化时,铜屑的作用是_______ 。
(2)X可能是_______ (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(3)如何证明氮化硅产品已用水洗干净?_______ 。
(4)推测氮化硅可能有哪些用途:_______ (填字母)。
a.制作切削刀具 b.制作坩埚 c.制作耐高温轴承 d.用作建筑材料
(5)工业上还可以采用化学气相沉积法制备氮化硅。在 的环境中,使
的环境中,使 与
与 在高温下反应生成氮化硅沉积在石墨表面,该反应的化学方程式为
在高温下反应生成氮化硅沉积在石墨表面,该反应的化学方程式为_______ 。
 (含少量
(含少量 )合成氮化硅的工艺流程如下:
)合成氮化硅的工艺流程如下:
(1)
 净化时,铜屑的作用是
净化时,铜屑的作用是(2)X可能是
(3)如何证明氮化硅产品已用水洗干净?
(4)推测氮化硅可能有哪些用途:
a.制作切削刀具 b.制作坩埚 c.制作耐高温轴承 d.用作建筑材料
(5)工业上还可以采用化学气相沉积法制备氮化硅。在
 的环境中,使
的环境中,使 与
与 在高温下反应生成氮化硅沉积在石墨表面,该反应的化学方程式为
在高温下反应生成氮化硅沉积在石墨表面,该反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】以废旧催化剂(主要成分为 、
、 ,还含有少量的
,还含有少量的 、
、 )为主要原料制备
)为主要原料制备 、
、 的工艺流程如图所示:
的工艺流程如图所示:
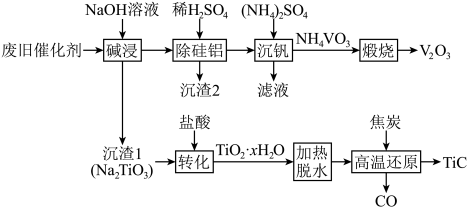
回答下列问题:
(1)“碱浸”后溶液中含钒元素的溶质是_______ (填化学式),实验室中将“沉渣1”从“碱浸”所得的悬浊液中分离出来所需玻璃仪器的名称为_______ 。
(2)“沉渣2”中含有两种成分,它们的化学式为_______ 。
(3)“转化”时发生反应的化学方程式为_______ 。
(4)“煅烧”时生成一种刺激性气味的气体,检验该气体常使用的试纸为_______ 。
(5)“高温还原”时 发生反应的化学方程式为
发生反应的化学方程式为_______ ,若生成30g还原产物,则转移电子的物质的量为_______ 。
 、
、 ,还含有少量的
,还含有少量的 、
、 )为主要原料制备
)为主要原料制备 、
、 的工艺流程如图所示:
的工艺流程如图所示:
回答下列问题:
(1)“碱浸”后溶液中含钒元素的溶质是
(2)“沉渣2”中含有两种成分,它们的化学式为
(3)“转化”时发生反应的化学方程式为
(4)“煅烧”时生成一种刺激性气味的气体,检验该气体常使用的试纸为
(5)“高温还原”时
 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次



