I.如图所示,是原电池的装置图。
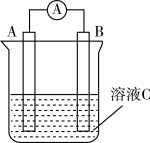
请回答:
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为________________________ ;反应进行一段时间后溶液C的pH将________ (填“升高”“降低”或“基本不变”)
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
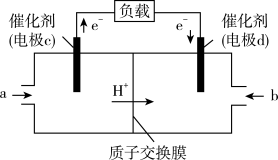
电池总反应为2CH3OH+3O2===2CO2+4H2O,
①则c电极是_______ (填“正极”或“负极”),c电极的反应方程式为____________________________ 。
②若线路中转移2 mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为________ L。
II.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
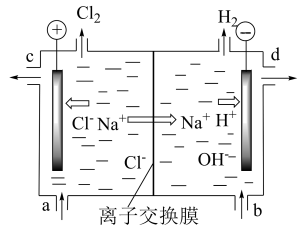
(1)写出电解饱和食盐水的离子方程式:____________________________________________ 。
(2)精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中______ 位置流出(选填“a”、“b”、“c”或“d”)。

请回答:
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

电池总反应为2CH3OH+3O2===2CO2+4H2O,
①则c电极是
②若线路中转移2 mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为
II.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:

(1)写出电解饱和食盐水的离子方程式:
(2)精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中
更新时间:2019-11-21 16:25:04
|
相似题推荐
【推荐1】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)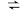 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) ΔH3=-90.77kJ·mol-1
CH3OH(g) ΔH3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的ΔH2=___________ 。
(2)反应Ⅲ能够自发进行的条件是___________ (填“较低温度”、“较高温度”或“任何温度”)。
(3)恒温,恒容密闭容器中,对于反应I,下列说法中能说明该反应达到化学平衡状态的是___________。
(4)对于反应I,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是___________。
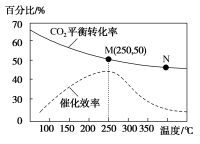
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应I,则图中M点时,产物甲醇的体积分数为___________ ;该温度下,反应的平衡常数K=___________ L2/mol2;若要进一步提高甲醇体积分数,可采取的措施有___________ 。
(6)通过上述反应制得的甲醇燃料电池在新能源领域中应用广泛,若采用 溶液为燃料电池的电解质溶液,则燃料电池的负极方程式为
溶液为燃料电池的电解质溶液,则燃料电池的负极方程式为___________ 。
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.58kJ·mol-1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g) ΔH3=-90.77kJ·mol-1
CH3OH(g) ΔH3=-90.77kJ·mol-1回答下列问题:
(1)反应Ⅱ的ΔH2=
(2)反应Ⅲ能够自发进行的条件是
(3)恒温,恒容密闭容器中,对于反应I,下列说法中能说明该反应达到化学平衡状态的是___________。
| A.混合气体的密度不再变化 |
| B.混合气体的平均相对分子质量不再变化 |
| C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1 |
| D.甲醇的百分含量不再变化 |

| A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率仍位于M |
| B.温度低于250℃时,随温度升高甲醇的产率增大 |
| C.M点时平衡常数比N点时平衡常数大 |
| D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率 |
(6)通过上述反应制得的甲醇燃料电池在新能源领域中应用广泛,若采用
 溶液为燃料电池的电解质溶液,则燃料电池的负极方程式为
溶液为燃料电池的电解质溶液,则燃料电池的负极方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】通过实验探究发现化学反应中的某种规律,再寻求理论上的科学合理解释,是化学工作者的重要研究方法。
I.在体积可变的密闭容器中投入1 mol CO和2molH2,不同条件下发生反应:CO(g)+2H2(g) CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。

(1)M点H2的转化率为___________ ;反应速率N点v正(CO)___________ M点ν逆(CO)(填“>”“<”或“=”)
(2)若M点对应混合气体的体积为1L,则506K时,该反应平衡常数K=___________ (保留三位小数)。图表示平衡常数的对数(lgK)与温度的关系,B、C点中能正确表示该反应的lgK与T的关系的点为___________ 。

(3)在2L恒容密闭容器中充入a mol H2、2 mol CO和7.4 mol CH3OH(g),在506K下进行上述反应。为了使该反应逆向进行,a的取值范围为___________ 。
Ⅱ.砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知H3AsO4的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(已知:pKa=-lgKa)。
回答下列问题:
(4)NaH2AsO4溶液呈___________ (填酸性”、“中性”或“碱性”),试通过计算说明___________ 。
(5)某小组同学欲探究可逆反应AsO33-+I2+2OH-⇌AsO43-+2I-+H2O,设计如图所示装置。加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向装置左边烧杯中逐滴加入一定量2 mol/L HCl,发现又产生电流,实验中电流与时间的关系如图所示。

写出图4中c点对应的正极反应式___________ ,能判断该反应达到平衡状态的是___________ 。
a.2v(I-)正=v(AsO33-)逆b.溶液pH不再变化
c.电流表示数变为零d.右边烧杯中c(K+)不变
I.在体积可变的密闭容器中投入1 mol CO和2molH2,不同条件下发生反应:CO(g)+2H2(g)
 CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
(1)M点H2的转化率为
(2)若M点对应混合气体的体积为1L,则506K时,该反应平衡常数K=

(3)在2L恒容密闭容器中充入a mol H2、2 mol CO和7.4 mol CH3OH(g),在506K下进行上述反应。为了使该反应逆向进行,a的取值范围为
Ⅱ.砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知H3AsO4的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(已知:pKa=-lgKa)。
回答下列问题:
(4)NaH2AsO4溶液呈
(5)某小组同学欲探究可逆反应AsO33-+I2+2OH-⇌AsO43-+2I-+H2O,设计如图所示装置。加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向装置左边烧杯中逐滴加入一定量2 mol/L HCl,发现又产生电流,实验中电流与时间的关系如图所示。

写出图4中c点对应的正极反应式
a.2v(I-)正=v(AsO33-)逆b.溶液pH不再变化
c.电流表示数变为零d.右边烧杯中c(K+)不变
您最近一年使用:0次
【推荐3】甲醇是一种可再生能源,具有开发和应用的广阔前景,其合成反应为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)下表列出了一些化学键断裂需要的能量数据,则CO(g)+2H2(g) CH3OH(g) △H=
CH3OH(g) △H=________ 。
工业上用天然气为原料合成甲醇,分为两阶段。
I制备合成气:CH4+H2O(g)=CO+3H2。
(2)为解决合成气中H2过量CO不足问题,原料气中添加CO2,发生反应CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为___ 。
Ⅱ合成甲醇
实验室进行模拟合成实验。将1 molCO和2molH2通入密闭容器中,测得CO在不同温度下的平衡转化率与压强的关系如图所示:

(3)比较T1、T2、T3的大小,并说明理由____ 。
(4)平衡常数K(b)___ K(d)、正反应速率v(a)___ v(b)(均填“大于”“小于”或“等于”)。
(5)c点时反应的压强平衡常数Kp=___ (kPa)-2(用数字表达式表示,Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(6)a点时,保持温度不变,将密闭容器的容积压缩刮原来的,对平衡体系产生的影响是______ 。
A. c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时 减小
减小 E. CH3OH的体积分数增加
E. CH3OH的体积分数增加
(7)科研人员设计了一种新型甲醇燃料电池,其电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,该电池工作时的负极电极反应式为________ 。
 CH3OH(g)。
CH3OH(g)。(1)下表列出了一些化学键断裂需要的能量数据,则CO(g)+2H2(g)
 CH3OH(g) △H=
CH3OH(g) △H=| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
工业上用天然气为原料合成甲醇,分为两阶段。
I制备合成气:CH4+H2O(g)=CO+3H2。
(2)为解决合成气中H2过量CO不足问题,原料气中添加CO2,发生反应CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为
Ⅱ合成甲醇
实验室进行模拟合成实验。将1 molCO和2molH2通入密闭容器中,测得CO在不同温度下的平衡转化率与压强的关系如图所示:

(3)比较T1、T2、T3的大小,并说明理由
(4)平衡常数K(b)
(5)c点时反应的压强平衡常数Kp=
(6)a点时,保持温度不变,将密闭容器的容积压缩刮原来的,对平衡体系产生的影响是
A. c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时
 减小
减小 E. CH3OH的体积分数增加
E. CH3OH的体积分数增加(7)科研人员设计了一种新型甲醇燃料电池,其电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,该电池工作时的负极电极反应式为
您最近一年使用:0次
【推荐1】(1)在恒容的密闭容器中,气体X与气体Y反应可生成气体Z,反应过程中,X、Y、Z三种气体的浓度(c)随时间(t)的变化关系如图_______ ,若t0=10s,用X表示的该反应速率为_______ ;若向容器中充入He,该反应速率_______ (填“加快”或“减慢”或“不变”)
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
①a=_______ 。
②能验证温度对化学反应速率规律的是实验_______ (填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______ (填“甲”或“乙”)。_______ (任写一条)。
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是_______ (填“黑磷”或“红磷”)。
(4)丙烷氧气燃料电池在碱性电解质环境中放电时丙烷在_______ (填“正”或“负”)极发生的电极反应式为_______ ,电路中每转移0.4mol电子,标准状况下消耗O2的体积是_______ L。

(2)一种新型催化剂用于NO和CO的反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
| 实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10−3 | 5.80×10−3 | 82 |
| Ⅱ | 280 | 1.2×10−3 | b | 124 |
| Ⅲ | 350 | a | 5.80×10−3 | 82 |
②能验证温度对化学反应速率规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线

(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是
(4)丙烷氧气燃料电池在碱性电解质环境中放电时丙烷在
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】短周期五种主族元素合A、B、C、D、E的原子序数依次增大。A、C的单质在常温下呈气态;C原子最外层电子数是其电子层数的3倍;B是形成有机物的主要元素;D能在BC2中燃烧重新生成B单质,其氧化物是一种耐高温材料;E和C位于同主族。回答下列问题:
(1)写出 的电子式:
的电子式:___________ ;
(2)D、E的简单离子中,离子半径大小关系是:_______ (用离子符号表示);
(3)D的单质能在BC2气体中燃烧,写出化学方程式:____________ ;
(4) 碱性燃料电池放电效率高,其正极反应式为:
碱性燃料电池放电效率高,其正极反应式为:_____________ 。
(1)写出
 的电子式:
的电子式:(2)D、E的简单离子中,离子半径大小关系是:
(3)D的单质能在BC2气体中燃烧,写出化学方程式:
(4)
 碱性燃料电池放电效率高,其正极反应式为:
碱性燃料电池放电效率高,其正极反应式为:
您最近一年使用:0次
【推荐3】甲烷在工农业生产、生活中有着重要作用,请回答下列问题。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)∆H1=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)∆H2
若在相同条件下,1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则∆H2=_________ 。
(2)用CH4催化还原NO,欲提高N2的平衡产率,应该采取的措施是_______ (填序号)。
A.升高温度B.增大压强C.降低温度D.降低压强
(3)一定温度下,在初始体积为2L恒压密闭容器中通入1molCH4和4molNO(假设只发生反应②),20min后该反应达到平衡,测得容器中N2的物质的量为0.8mol。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=________________ ,该温度下反应的平衡常数K=_______________ 。(答案可用分数表示)
(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得N2的产率与温度的关系如图所示,OA段N2产率增大的原因是_________ 。

(5)对于反应②而言,不同温度下,CH4的浓度变化如图所示,下列说法正确的是__________ (填序号)。

A.T1大于T2
B.c时二氧化碳的浓度为0.2mol/L
C.a点正反应速率大于b点的逆反应速率
D.a点的反应速率一定比c点的反应速率小
(6)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液,该甲烷燃料电池中,负极反应方程式为_______ 。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)∆H1=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)∆H2
若在相同条件下,1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则∆H2=
(2)用CH4催化还原NO,欲提高N2的平衡产率,应该采取的措施是
A.升高温度B.增大压强C.降低温度D.降低压强
(3)一定温度下,在初始体积为2L恒压密闭容器中通入1molCH4和4molNO(假设只发生反应②),20min后该反应达到平衡,测得容器中N2的物质的量为0.8mol。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=
(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得N2的产率与温度的关系如图所示,OA段N2产率增大的原因是

(5)对于反应②而言,不同温度下,CH4的浓度变化如图所示,下列说法正确的是

A.T1大于T2
B.c时二氧化碳的浓度为0.2mol/L
C.a点正反应速率大于b点的逆反应速率
D.a点的反应速率一定比c点的反应速率小
(6)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液,该甲烷燃料电池中,负极反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
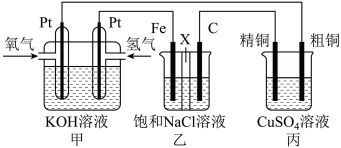
(1)石墨电极为___________ (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入“酚酞”溶液,___________ (填“铁极”或“石墨极”)区的溶液先变红。乙池中阴极的电极反应式为___________ 。
(2)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,溶液中硫酸铜浓度将___________ (填“增大”“减小”或“不变”)。精铜电极上的电极反应式为___________ 。
(3)若在标准状况下,有 氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为
氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为___________  ;丙装置中阴极析出铜的质量为
;丙装置中阴极析出铜的质量为___________ g。
(4)若将甲改用 和
和 的熔融盐混合物作电解质,
的熔融盐混合物作电解质, 为负极燃气,空气与
为负极燃气,空气与 的混合气为正极助燃气,制得燃料电池,则该电池负极反应式为
的混合气为正极助燃气,制得燃料电池,则该电池负极反应式为___________ 。

(1)石墨电极为
(2)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,溶液中硫酸铜浓度将
(3)若在标准状况下,有
 氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为
氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为 ;丙装置中阴极析出铜的质量为
;丙装置中阴极析出铜的质量为(4)若将甲改用
 和
和 的熔融盐混合物作电解质,
的熔融盐混合物作电解质, 为负极燃气,空气与
为负极燃气,空气与 的混合气为正极助燃气,制得燃料电池,则该电池负极反应式为
的混合气为正极助燃气,制得燃料电池,则该电池负极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】I.完成下列问题。
(1) 以及其它部分弱酸的电离平衡常数如表:
以及其它部分弱酸的电离平衡常数如表:
按要求回答下列问题:
① 、
、 、HClO的酸性由强到弱的顺序为
、HClO的酸性由强到弱的顺序为___________ 。
②将少量 气体通入NaClO溶液中,写出该反应的离子方程式:
气体通入NaClO溶液中,写出该反应的离子方程式:___________ 。
③测得
 溶液
溶液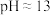 。溶液中
。溶液中 、
、 、
、 三种离子浓度由大到小的顺序依次是
三种离子浓度由大到小的顺序依次是___________ 。
(2)常温下,已知 一元酸HCOOH(甲酸)溶液中
一元酸HCOOH(甲酸)溶液中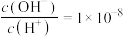 。
。
①
 的
的
___________ 。
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是___________ (填序号)
A.所有离子的浓度在稀释过程中都会减少
B、稀释后溶液的
C.稀释后甲酸的电离度会增大
Ⅱ.某同学设计利用一氧化氮——空气质子交换膜燃料电池将化学能转化为电能,实现了制硝酸、发电、环保三位一体的结合。
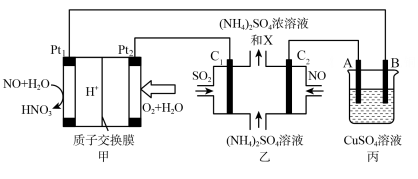
(3)甲装置中 上的电极反应式为
上的电极反应式为___________ 。
(4)乙装置中 上的电极反应式
上的电极反应式___________ 。
(5)装置丙用于粗铜的精炼。装置中电极A是___________ (填“粗铜”或“纯铜”)。
(1)
 以及其它部分弱酸的电离平衡常数如表:
以及其它部分弱酸的电离平衡常数如表:| 弱酸 |  |  | HClO |
| 电离平衡常数(25℃) | 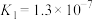  | 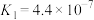  | 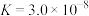 |
①
 、
、 、HClO的酸性由强到弱的顺序为
、HClO的酸性由强到弱的顺序为②将少量
 气体通入NaClO溶液中,写出该反应的离子方程式:
气体通入NaClO溶液中,写出该反应的离子方程式:③测得

 溶液
溶液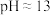 。溶液中
。溶液中 、
、 、
、 三种离子浓度由大到小的顺序依次是
三种离子浓度由大到小的顺序依次是(2)常温下,已知
 一元酸HCOOH(甲酸)溶液中
一元酸HCOOH(甲酸)溶液中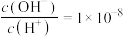 。
。①

 的
的
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是
A.所有离子的浓度在稀释过程中都会减少
B、稀释后溶液的

C.稀释后甲酸的电离度会增大
Ⅱ.某同学设计利用一氧化氮——空气质子交换膜燃料电池将化学能转化为电能,实现了制硝酸、发电、环保三位一体的结合。

(3)甲装置中
 上的电极反应式为
上的电极反应式为(4)乙装置中
 上的电极反应式
上的电极反应式(5)装置丙用于粗铜的精炼。装置中电极A是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
(1)甲装置中通入氧气的电极为______________ (填“正极”或“负极”),负极的电极反应式为_________________ 。
(2)乙装置中铁电极为_______ (填“阳极”或“阴极”),石墨电极(C)上发生_____ 反应(填“氧化”或“还原”),其电极反应式为___________________ 。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在_____________ 区。(填“铁极”或“石墨极”)
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______ (填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为_____ ;丙装置中阴极析出铜的质量为_____________ 。

根据要求回答相关问题:
(1)甲装置中通入氧气的电极为
(2)乙装置中铁电极为
(3)反应一段时间后,乙装置中生成氢氧化钠主要在
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
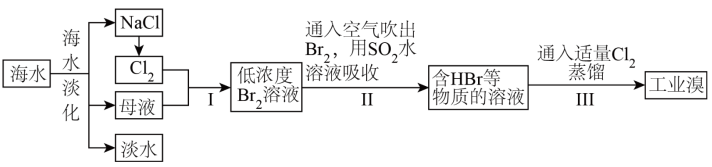
(1)请列举海水淡化的三种方法:_______ 。
(2)用惰性电极,将 溶液进行电解,写出化学方程式
溶液进行电解,写出化学方程式_______ 。
(3)步骤I中已获得 ,步骤II中将
,步骤II中将 还原为
还原为 ,其目的为
,其目的为_______ 。
(4)步骤II用 水溶液吸收
水溶液吸收 ,吸收率可达
,吸收率可达 ,有关反应的离子方程式为
,有关反应的离子方程式为_______ ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______ 。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料, 的沸点为
的沸点为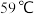 。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,做了如下装置简图:
。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,做了如下装置简图:

请你参与分析讨论:
①图中仪器 的名称:
的名称:_______ 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_______ 。
③为除去该产物中仍残留的少量 ,可向其中加入
,可向其中加入 溶液,充分反应后,再进行的分离操作是
溶液,充分反应后,再进行的分离操作是_______ 。

(1)请列举海水淡化的三种方法:
(2)用惰性电极,将
 溶液进行电解,写出化学方程式
溶液进行电解,写出化学方程式(3)步骤I中已获得
 ,步骤II中将
,步骤II中将 还原为
还原为 ,其目的为
,其目的为(4)步骤II用
 水溶液吸收
水溶液吸收 ,吸收率可达
,吸收率可达 ,有关反应的离子方程式为
,有关反应的离子方程式为(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,
 的沸点为
的沸点为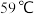 。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,做了如下装置简图:
。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,做了如下装置简图:
请你参与分析讨论:
①图中仪器
 的名称:
的名称:②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
③为除去该产物中仍残留的少量
 ,可向其中加入
,可向其中加入 溶液,充分反应后,再进行的分离操作是
溶液,充分反应后,再进行的分离操作是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。
(1)如图所示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,'写出阳极产生ClO2的电极方程式:___ ;图中b电极为___ (填“阳极”或“阴极’”)。
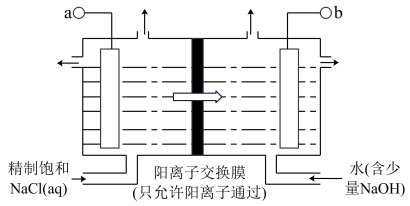
(2)电解一段时间,当阴极产生标准状况下气体112mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为___ mol,阴极区pH___ (填“变大”“变小”或“不变”)。.
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(amol·L-1),现用ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:___ 。
(4)“84消毒液”是常用的消毒剂。电解氯化钠稀溶液也可制备“84消毒液”,若通电时氯气被溶液完全吸收,所得消毒液仅含一种溶质,写出相应的化学反应方程式:___ 。
(1)如图所示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,'写出阳极产生ClO2的电极方程式:

(2)电解一段时间,当阴极产生标准状况下气体112mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(amol·L-1),现用ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:
(4)“84消毒液”是常用的消毒剂。电解氯化钠稀溶液也可制备“84消毒液”,若通电时氯气被溶液完全吸收,所得消毒液仅含一种溶质,写出相应的化学反应方程式:
您最近一年使用:0次
【推荐3】下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,H、I、J都为氧化物,C的焰色反应为黄色,M为红褐色固体。

(1)写出: J的结构式______ ,M的化学式_______ ;
(2)基于反应①原理的化学工业称为______ ;写出该反应的化学方程式_______ ;
(3)写出K溶液和E反应的离子方程式_____ ;写出F溶液和H反应的离子方程式______ ;
(4)已知由G分解得到的H、I、J三者的物质的量相等,则G的化学式为_____

(1)写出: J的结构式
(2)基于反应①原理的化学工业称为
(3)写出K溶液和E反应的离子方程式
(4)已知由G分解得到的H、I、J三者的物质的量相等,则G的化学式为
您最近一年使用:0次



