氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
①ΔH 1_____ 0,ΔH 3_____ 0。(填“>”或“<”)
②N2(g)+O2(g) = 2NO(g) ΔH=______ kJ·mol-1。
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是_______ (填字母)。
A.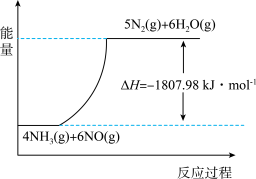
B.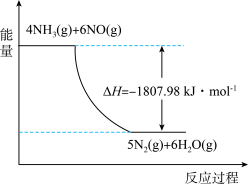
C.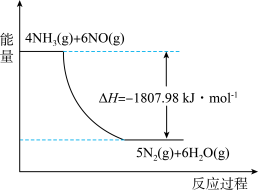
(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
则CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=________ ,1.6 g CH4还原NO2 生成N2和液态水时放出的热量为______ kJ。
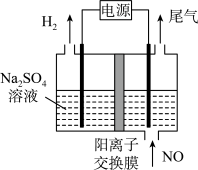
(4)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极),电解过程中NO转化为硝酸的化学方程式为______ 。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
| 反应 | N2(g)→2N(g) | O2(g)→2O(g) | N(g)+O(g)→NO(g) |
| 反应热 | ΔH 1 | ΔH 2 | ΔH 3 |
| 热量值kJ·mol-1 | 945 | 498 | 630 |
①ΔH 1
②N2(g)+O2(g) = 2NO(g) ΔH=
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是
A.

B.

C.

(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
则CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=
(4)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极),电解过程中NO转化为硝酸的化学方程式为

更新时间:2019-12-08 19:07:10
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
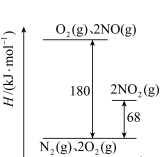
I.(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2 mol NO2的能量变化)。1 mol NO氧化为NO2的焓变△H=___________ kJ/mol。
(2)某温度下,反应的平衡常数如下:
a.2NO2(g) N2(g)+2O2(g) K=6.7×1016
N2(g)+2O2(g) K=6.7×1016
b.2NO(g) N2(g)+O2(g) K=2.2×1030
N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___________ (填“a”或“b”);反应2NO(g)+O2(g) 2NO2(g)的K=
2NO2(g)的K=___________ 。
(3)已知反应2NO(g)+O2(g) 2NO2(g)的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,该反应的历程为:
2NO2(g)的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,该反应的历程为:
第一步:NO+NO=N2O2快速平衡
第二步:N2O2+O2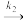 2NO2慢反应
2NO2慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),ν(逆)=k-1c(N2O2)。下列叙述正确的是___________ (填字母)。
A.第一步反应的平衡常数K=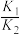
B.v(第一步的正反应)<v(第二步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
Ⅱ.氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。工业上可利用反应2C12(g)+NH3(g) NHCl2(l)+HCl(g)制备二氯胺。
NHCl2(l)+HCl(g)制备二氯胺。
(1)二氯氨在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出具有强杀菌作用的物质的电子式______________________ 。
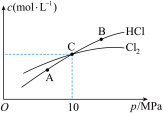
(2)在恒温条件下,将2 mol Cl2和1 mol NH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是___________ 点(填“A”“B”或“C”);计算C点时该反应的压强平衡常数Kp(C)=___________ (Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数。)
I.(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2 mol NO2的能量变化)。1 mol NO氧化为NO2的焓变△H=

(2)某温度下,反应的平衡常数如下:
a.2NO2(g)
 N2(g)+2O2(g) K=6.7×1016
N2(g)+2O2(g) K=6.7×1016b.2NO(g)
 N2(g)+O2(g) K=2.2×1030
N2(g)+O2(g) K=2.2×1030分解反应趋势较大的反应是
 2NO2(g)的K=
2NO2(g)的K=(3)已知反应2NO(g)+O2(g)
 2NO2(g)的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,该反应的历程为:
2NO2(g)的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,该反应的历程为:第一步:NO+NO=N2O2快速平衡
第二步:N2O2+O2
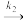 2NO2慢反应
2NO2慢反应其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),ν(逆)=k-1c(N2O2)。下列叙述正确的是
A.第一步反应的平衡常数K=
B.v(第一步的正反应)<v(第二步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
Ⅱ.氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。工业上可利用反应2C12(g)+NH3(g)
 NHCl2(l)+HCl(g)制备二氯胺。
NHCl2(l)+HCl(g)制备二氯胺。(1)二氯氨在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出具有强杀菌作用的物质的电子式
(2)在恒温条件下,将2 mol Cl2和1 mol NH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】研究化学反应中的能量变化对生产、生活有重要的意义。
(1)某氮肥厂含氮废水中的氮元素多以 和
和 形式存在,处理过程中
形式存在,处理过程中 在微生物的作用下经过两步反应被氧化成
在微生物的作用下经过两步反应被氧化成 ,反应过程中的能量变化如图所示:
,反应过程中的能量变化如图所示:
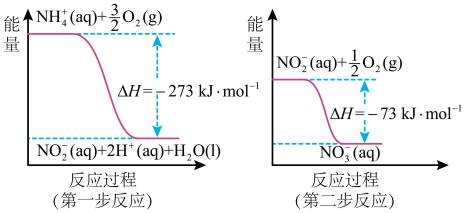
 全部被氧化成
全部被氧化成
___________ (填“吸收”或“放出”)的热量是___________ kJ,写出热化学方程式___________ 。
(2)已知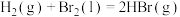
 ,蒸发
,蒸发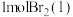 吸收的能量为30kJ,其他相关数据如下表:
吸收的能量为30kJ,其他相关数据如下表:
则表中a=___________ 。
(3)已知:常温下,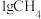 在足量的氧气中完全燃烧时放出55.6kJ热量,请写出该反应燃烧热化学方程式:
在足量的氧气中完全燃烧时放出55.6kJ热量,请写出该反应燃烧热化学方程式:___________ 。
(4)高炉炼铁基本反应: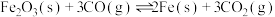 ,其平衡常数表达式为:
,其平衡常数表达式为:___________ 。
(5)已知:
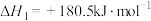 ;
;

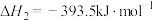 ;
;

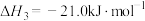
若某反应(反应物与生成物均为气体)的平衡常数表达式为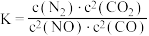 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
(1)某氮肥厂含氮废水中的氮元素多以
 和
和 形式存在,处理过程中
形式存在,处理过程中 在微生物的作用下经过两步反应被氧化成
在微生物的作用下经过两步反应被氧化成 ,反应过程中的能量变化如图所示:
,反应过程中的能量变化如图所示:
 全部被氧化成
全部被氧化成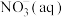
(2)已知
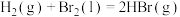
 ,蒸发
,蒸发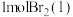 吸收的能量为30kJ,其他相关数据如下表:
吸收的能量为30kJ,其他相关数据如下表:| 物质 |  | 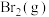 | HBr(g) |
| 键能/kJ/mol | 436 | 200 | a |
(3)已知:常温下,
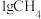 在足量的氧气中完全燃烧时放出55.6kJ热量,请写出该反应燃烧热化学方程式:
在足量的氧气中完全燃烧时放出55.6kJ热量,请写出该反应燃烧热化学方程式:(4)高炉炼铁基本反应:
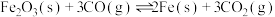 ,其平衡常数表达式为:
,其平衡常数表达式为:(5)已知:

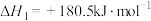 ;
;
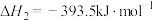 ;
;
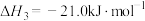
若某反应(反应物与生成物均为气体)的平衡常数表达式为
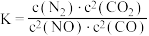 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:
CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) ΔH2=-90kJ•mol-1
总反应的ΔH=___________ kJ•mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是 ___________ (填标号)。
A.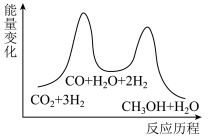 B.
B. 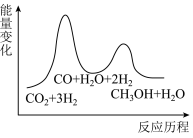
C.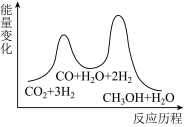 D.
D. 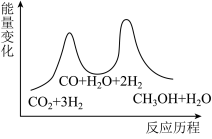
(2)合成总反应在起始物 3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下,x(CH3OH)与压强的关系(x(CH3OH)~p)和在p=5×105Pa下,x(CH3OH)与温度的关系(x(CH3OH)~t)分别如图所示,请回答下列问题:
3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下,x(CH3OH)与压强的关系(x(CH3OH)~p)和在p=5×105Pa下,x(CH3OH)与温度的关系(x(CH3OH)~t)分别如图所示,请回答下列问题:
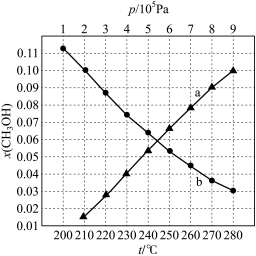
①图中对应等压过程的曲线是___________ ,判断的理由是 ___________ 。
②当x(CH3OH)=0.10时,CO2的平衡转化率α=___________ (保留两位有效数字),反应条件可能为 ___________ 。
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:
CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:①CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) ΔH2=-90kJ•mol-1
总反应的ΔH=
A.
 B.
B. 
C.
 D.
D. 
(2)合成总反应在起始物
 3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下,x(CH3OH)与压强的关系(x(CH3OH)~p)和在p=5×105Pa下,x(CH3OH)与温度的关系(x(CH3OH)~t)分别如图所示,请回答下列问题:
3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下,x(CH3OH)与压强的关系(x(CH3OH)~p)和在p=5×105Pa下,x(CH3OH)与温度的关系(x(CH3OH)~t)分别如图所示,请回答下列问题:
①图中对应等压过程的曲线是
②当x(CH3OH)=0.10时,CO2的平衡转化率α=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】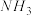 作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应Ⅰ: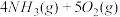

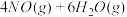 △H=
△H=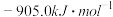
反应Ⅱ: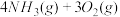
 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) 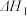
(1)在恒温恒容装置中充入一定量的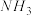 和
和 ,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是
,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是___________________ 。
A. 使用催化剂时,可降低该反应的活化能,加快其反应速率
B. 若测得容器内 时,说明反应已达平衡
时,说明反应已达平衡
C. 当容器内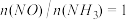 时,说明反应已达平衡
时,说明反应已达平衡
D. 当测得容器内氧气浓度不再变化时,说明反应已达达平衡
(2)氨催化氧化时会发生上述两个竞争反应Ⅰ、Ⅱ。为分析某催化剂对该反应的选择性,1L密闭容器中充入1 mol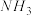 和2 mol
和2 mol  ,测得有关物质的量关系如图
,测得有关物质的量关系如图
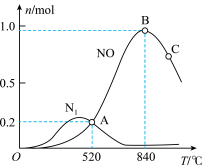
①该催化剂在高温时选择反应_______________ (填“Ⅰ”或“Ⅱ”)。
②520℃时,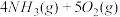

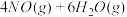 的平衡常数K表达式
的平衡常数K表达式________ 。
③有利于提高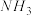 转化为
转化为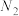 的速率的措施有
的速率的措施有_________________ 。
A. 使用催化剂
B. 将反应生成的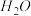 及时移出
及时移出
C. 充入稀有气体
D. 投料比不变,增加反应物的浓度
E. 降低反应温度
(3)最近华南理工大提出利用电解法制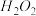 并用产生的
并用产生的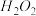 处理废氨水,装置如图
处理废氨水,装置如图

①为了不影响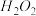 的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)
的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)_________ c(NO3-)(填>、=、<)。
②Ir-Ru惰性电极有吸附 作用,该电极上产生
作用,该电极上产生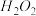 的反应为
的反应为_________ ,生成的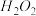 与废液反应的离子方程式为
与废液反应的离子方程式为_________________ 。
③理论上电路中每转移3 mol电子,最多可以处理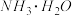 的物质的量为
的物质的量为__________ 。
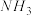 作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:反应Ⅰ:
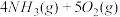

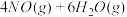 △H=
△H=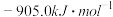
反应Ⅱ:
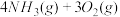
 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) 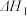
(1)在恒温恒容装置中充入一定量的
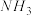 和
和 ,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是
,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是A. 使用催化剂时,可降低该反应的活化能,加快其反应速率
B. 若测得容器内
 时,说明反应已达平衡
时,说明反应已达平衡C. 当容器内
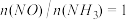 时,说明反应已达平衡
时,说明反应已达平衡D. 当测得容器内氧气浓度不再变化时,说明反应已达达平衡
(2)氨催化氧化时会发生上述两个竞争反应Ⅰ、Ⅱ。为分析某催化剂对该反应的选择性,1L密闭容器中充入1 mol
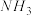 和2 mol
和2 mol  ,测得有关物质的量关系如图
,测得有关物质的量关系如图
①该催化剂在高温时选择反应
②520℃时,
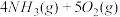

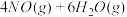 的平衡常数K表达式
的平衡常数K表达式③有利于提高
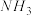 转化为
转化为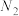 的速率的措施有
的速率的措施有A. 使用催化剂
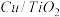
B. 将反应生成的
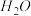 及时移出
及时移出C. 充入稀有气体
D. 投料比不变,增加反应物的浓度
E. 降低反应温度
(3)最近华南理工大提出利用电解法制
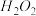 并用产生的
并用产生的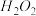 处理废氨水,装置如图
处理废氨水,装置如图
①为了不影响
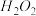 的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)
的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)②Ir-Ru惰性电极有吸附
 作用,该电极上产生
作用,该电极上产生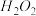 的反应为
的反应为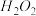 与废液反应的离子方程式为
与废液反应的离子方程式为③理论上电路中每转移3 mol电子,最多可以处理
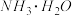 的物质的量为
的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】环成二烯(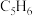 )是一种重要的有机化工原料。
)是一种重要的有机化工原料。
Ⅰ.环戊二烯容易反应生成双环戊二烯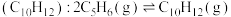 。不同温度下,溶液中环戊二烯(
。不同温度下,溶液中环戊二烯(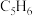 )浓度(初始浓度为
)浓度(初始浓度为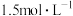 )与反应时间的关系如图所示。
)与反应时间的关系如图所示。
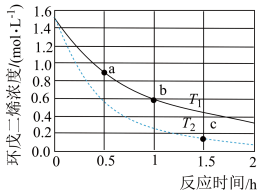
(1)反应开始至b点时,用双环戊二烯(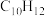 )表示的平均速率为
)表示的平均速率为___________  (小数表示)。
(小数表示)。
(2)
___________  (填“大于”、“小于”或“等于”);
(填“大于”、“小于”或“等于”);
(3)a点的正反应速率___________ b点的逆反应速率(填“大于”、“小于”或“等于”)。
Ⅱ.可用环戊二烯(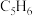 )制备环戊烯(
)制备环戊烯(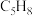 )。有如下反应:
)。有如下反应:
反应ⅰ: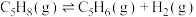
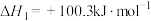
反应ⅱ:
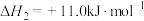
反应ⅲ: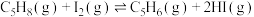

(4)反应ⅲ的焓变
___________  。
。
(5)某温度时在恒容密闭容器中充入等物质的量的碘和环戊烯发生反应ⅲ,起始总压为 ,平衡时总压为
,平衡时总压为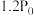 。
。
①平衡时环戊烯(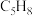 )的体积分数为
)的体积分数为___________  。
。
②用平衡分压(分压 总压
总压 物质的量分数)代替平衡浓度计算压强平衡常数
物质的量分数)代替平衡浓度计算压强平衡常数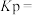
___________ 。
A.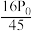 B.
B.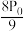 C.
C.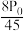 D.
D.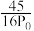
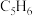 )是一种重要的有机化工原料。
)是一种重要的有机化工原料。Ⅰ.环戊二烯容易反应生成双环戊二烯
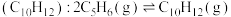 。不同温度下,溶液中环戊二烯(
。不同温度下,溶液中环戊二烯(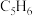 )浓度(初始浓度为
)浓度(初始浓度为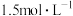 )与反应时间的关系如图所示。
)与反应时间的关系如图所示。
(1)反应开始至b点时,用双环戊二烯(
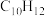 )表示的平均速率为
)表示的平均速率为 (小数表示)。
(小数表示)。(2)

 (填“大于”、“小于”或“等于”);
(填“大于”、“小于”或“等于”);(3)a点的正反应速率
Ⅱ.可用环戊二烯(
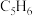 )制备环戊烯(
)制备环戊烯(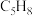 )。有如下反应:
)。有如下反应:反应ⅰ:
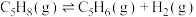
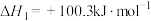
反应ⅱ:

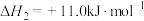
反应ⅲ:
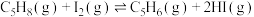

(4)反应ⅲ的焓变

 。
。(5)某温度时在恒容密闭容器中充入等物质的量的碘和环戊烯发生反应ⅲ,起始总压为
 ,平衡时总压为
,平衡时总压为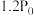 。
。①平衡时环戊烯(
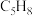 )的体积分数为
)的体积分数为 。
。②用平衡分压(分压
 总压
总压 物质的量分数)代替平衡浓度计算压强平衡常数
物质的量分数)代替平衡浓度计算压强平衡常数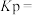
A.
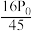 B.
B.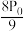 C.
C.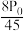 D.
D.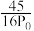
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0
①该反应中,反应物总能量_____ (填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为____________ mol。
③该反应中,还原剂为_____________ (填化学式),氧化产物与还原产物的质量比为______________ 。
(2)也可以利用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是_________________________________ 。
(3)还可利用ClO2 消除氮氧化物的污染,反应过程如下(部分反应物或生成物略去):
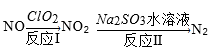
反应I的产物中还有两种强酸生成,且其中一种强酸为硝酸,且硝酸与NO2物质的量相等,则化学反应方程式为______ ,反应中若生成22.4L N2(标准状况),则消耗ClO2______ g。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0
①该反应中,反应物总能量
②当该反应有2mol N2(g)生成时,转移电子的物质的量为
③该反应中,还原剂为
(2)也可以利用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是
(3)还可利用ClO2 消除氮氧化物的污染,反应过程如下(部分反应物或生成物略去):
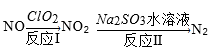
反应I的产物中还有两种强酸生成,且其中一种强酸为硝酸,且硝酸与NO2物质的量相等,则化学反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氮族元素单质及其化合物有着广泛应用。
(1)在1. 0 L密闭容器中放入0. 10mol PCl5(g),一定温度进行如下反应:PCl5(g) PCl3(g)+Cl2(g) ΔH1,反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:
PCl3(g)+Cl2(g) ΔH1,反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:
回答下列问题:
①PCl3的电子式为_______ 。
②T1温度下,反应平衡常数K=______ 。
③T1___ T2(填“>”、“<”或“=”,下同),PCl5的平衡转化率α1(T1) __ α2(T2)。
(2)NO在一定条件下发生如下分解:3NO(g) N2O(g)+NO2(g)
N2O(g)+NO2(g)
在温度和容积不变的条件下,能说明该反应已达到平衡状态的是________ (填字母序号)。
a. n(N2O)=n(NO2) b. 容器内压强保持不变 c. v正(N2O)=v逆(NO2) d. 气体颜色保持不变
(3)次磷酸钴[Co(H2PO2)2]广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如下图。
①Co的电极反应式为_______ 。
②A、B、C为离子交换膜,其中B为____ 离子交换膜(填“阳”或“阴”)。
(1)在1. 0 L密闭容器中放入0. 10mol PCl5(g),一定温度进行如下反应:PCl5(g)
 PCl3(g)+Cl2(g) ΔH1,反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:
PCl3(g)+Cl2(g) ΔH1,反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:| 时间t/s 温度 | 0 | t1 | t2 | t3 | t4 | t5 |
| T1 | 5. 00 | 7. 31 | 8. 00 | 8. 50 | 9. 00 | 9. 00 |
| T2 | 6. 00 | -- | -- | -- | 11. 00 | 11. 00 |
回答下列问题:
①PCl3的电子式为
②T1温度下,反应平衡常数K=
③T1
(2)NO在一定条件下发生如下分解:3NO(g)
 N2O(g)+NO2(g)
N2O(g)+NO2(g)在温度和容积不变的条件下,能说明该反应已达到平衡状态的是
a. n(N2O)=n(NO2) b. 容器内压强保持不变 c. v正(N2O)=v逆(NO2) d. 气体颜色保持不变
(3)次磷酸钴[Co(H2PO2)2]广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如下图。
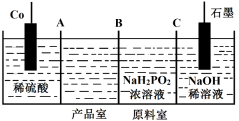
①Co的电极反应式为
②A、B、C为离子交换膜,其中B为
您最近一年使用:0次
【推荐2】氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素 的碱性溶液制氢气的装置示意图
的碱性溶液制氢气的装置示意图 电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极
电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极 。
。
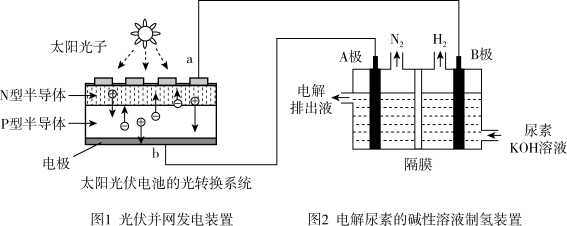
(1)图1中N型半导体为______  填“正极”或“负极”
填“正极”或“负极”
(2)该系统工作时,A极的电极反应式为______
(3)若A极产生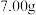
 ,则此时B极产生
,则此时B极产生______ L  标况下
标况下 。
。
 的碱性溶液制氢气的装置示意图
的碱性溶液制氢气的装置示意图 电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极
电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极 。
。
(1)图1中N型半导体为
 填“正极”或“负极”
填“正极”或“负极”
(2)该系统工作时,A极的电极反应式为
(3)若A极产生
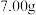
 ,则此时B极产生
,则此时B极产生 标况下
标况下 。
。
您最近一年使用:0次
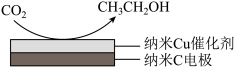
【推荐3】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如下图所示:
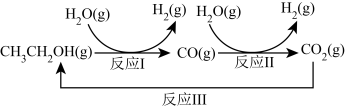
(1)已知:CO(g)+H2O(g) CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g) 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
请写出反应I的热化学方程式_____________________________ 。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO平衡转化率见下图
(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。
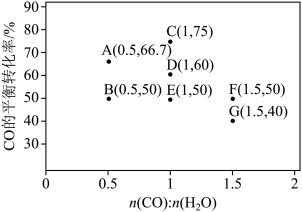
① 经分析,A、E和G三点对应的反应温度相同,其原因是KA=KE=KG=________ (填数值)。在该温度下:要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是________ 。
② 对比分析B、E、F三点,可得出对应的进气比和反应温度的变化趋势之间的关系是_____________________________________________________________ 。
③ 比较A、B两点对应的反应速率大小:VA______ VB(填“<” “=”或“>”)。反应速率v=v正-v逆=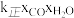 -
- ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时 =
=__________ (计算结果保留1位小数)。
(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。
①已知碳酸的电离常数Ka1=10-a,Ka2=10-b,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中lg =
=____________________________________ (列出计算式)。
②在饱和KHCO3电解液中电解CO2来制备乙醇的原理如图所示。则阴极的电极反应式是_____________________________________________________________________ 。

(1)已知:CO(g)+H2O(g)
 CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/molCH3CH2OH(g)+3H2O(g)
 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol请写出反应I的热化学方程式
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO平衡转化率见下图
(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。

① 经分析,A、E和G三点对应的反应温度相同,其原因是KA=KE=KG=
② 对比分析B、E、F三点,可得出对应的进气比和反应温度的变化趋势之间的关系是
③ 比较A、B两点对应的反应速率大小:VA
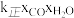 -
- ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时 =
=(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。
①已知碳酸的电离常数Ka1=10-a,Ka2=10-b,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中lg
 =
=②在饱和KHCO3电解液中电解CO2来制备乙醇的原理如图所示。则阴极的电极反应式是

您最近一年使用:0次



