铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)简单鉴别Fe(OH)3胶体和FeCl3溶液的方法是_______________ 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请用双线桥表示出电子转移的方向和数目_____________________
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则可检出待测液中含有的金属阳离子是_____ ;
②验证该溶液中含有Fe2+,正确的实验方法是_______ (用字母代号填)。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
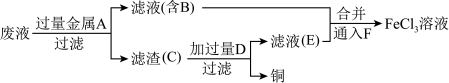
①滤渣C的主要成分的化学式为_______ 、_______ 。
②加过量D发生反应的离子方程式为__________________________________ 。
③通入F发生反应的化学方程式为___________________________________ 。
(1)简单鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请用双线桥表示出电子转移的方向和数目
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则可检出待测液中含有的金属阳离子是
②验证该溶液中含有Fe2+,正确的实验方法是
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣C的主要成分的化学式为
②加过量D发生反应的离子方程式为
③通入F发生反应的化学方程式为
更新时间:2019-12-16 09:22:52
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】KMnO4是一种典型的强氧化剂。完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O (未配平)
② MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O (未配平)
(1)下列关于反应①的说法中错误的是_________ (选填编号)。
a.被氧化的元素是Cu和S b.氧化剂与还原剂的物质的量之比为8:5
c.还原性的强弱关系是: Mn2+<Cu2S d.每生成2.24 L(标况) SO2,转移0.6mol电子
(2)配平并标出反应②中电子转移的方向和数目 :_____
MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O
(3)若将H2O2加入KMnO4有反应:2KMnO4+7H2O2+3H2SO4= K2SO4+2MnSO4+6O2↑+10H2O,则被1molKMnO4氧化的H2O2是_________ mol。
II.已知在碱性条件下:MnO4-+e-—→MnO42- (绿色)
(4) 将KMnO4溶液滴入NaOH溶液中微热,得到透明的绿色溶液,并且有气泡生成,写出反应的离子方程式_____________ 。
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O (未配平)
② MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O (未配平)
(1)下列关于反应①的说法中错误的是
a.被氧化的元素是Cu和S b.氧化剂与还原剂的物质的量之比为8:5
c.还原性的强弱关系是: Mn2+<Cu2S d.每生成2.24 L(标况) SO2,转移0.6mol电子
(2)配平
MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O
(3)若将H2O2加入KMnO4有反应:2KMnO4+7H2O2+3H2SO4= K2SO4+2MnSO4+6O2↑+10H2O,则被1molKMnO4氧化的H2O2是
II.已知在碱性条件下:MnO4-+e-—→MnO42- (绿色)
(4) 将KMnO4溶液滴入NaOH溶液中微热,得到透明的绿色溶液,并且有气泡生成,写出反应的离子方程式
您最近一年使用:0次
【推荐2】I.已知铜在常温下能被稀HNO3溶解,反应为:3Cu+8HNO3=3Cu(NO3)2+2NO↑十4H2O。
(1)请将上述反应改写成离子方程式________________________ 。
(2)上述反应中,氧化剂是___________ (填化学式),氧化产物是___________ (填化学式)。
(3)用双线桥法 标出该反应的电子转移情况。
(4)若反应中转移了6mol电子,则生成的NO气体的体积在标准状况下为___________ L 。
II. 某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是_________________ 。
(2)该反应中,发生还原反应的过程是________ →__________ 。(从上述五种物质中选取两种)
(3)根据上述反应可推知_________________ (填字母)
a. 氧化性:Cr(OH)3> H2CrO4 b. 氧化性:H2CrO4>O2
c. 还原性:H2O>H2O2 d. 还原性:H2O2>Cr(OH)3
(1)请将上述反应改写成离子方程式
(2)上述反应中,氧化剂是
(3)用
(4)若反应中转移了6mol电子,则生成的NO气体的体积在标准状况下为
II. 某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是
(2)该反应中,发生还原反应的过程是
(3)根据上述反应可推知
a. 氧化性:Cr(OH)3> H2CrO4 b. 氧化性:H2CrO4>O2
c. 还原性:H2O>H2O2 d. 还原性:H2O2>Cr(OH)3
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】请按要求回答下列问题:
(1)按照物质的分类方法, 应属于
应属于___________ (填序号)。
①酸②氯化物③混合物④盐⑤化合物⑥电解质
(2)写出 在水中的电离方程式
在水中的电离方程式___________ 。
(3)铁元素是人体内一种微量元素,主要以Fe2+的形式存在。请回答下列问题:
①下列微粒中,既有氧化性又有还原性的是___________ (填字母)。
A.Fe B.Fe2+ C.Fe3+
②维生素C可使食物中的Fe3+转化为Fe2+,在此过程中___________ 是还原剂
③某种麦片中含有微量的细小铁粉,食用该麦片后,铁粉与胃酸反应的离子方程式是___________ 。
④含硫酸亚铁的药片可治疗缺铁性贫血,可用___________ 溶液检验该硫酸亚铁药片是否变质。
(1)按照物质的分类方法,
 应属于
应属于①酸②氯化物③混合物④盐⑤化合物⑥电解质
(2)写出
 在水中的电离方程式
在水中的电离方程式(3)铁元素是人体内一种微量元素,主要以Fe2+的形式存在。请回答下列问题:
①下列微粒中,既有氧化性又有还原性的是
A.Fe B.Fe2+ C.Fe3+
②维生素C可使食物中的Fe3+转化为Fe2+,在此过程中
③某种麦片中含有微量的细小铁粉,食用该麦片后,铁粉与胃酸反应的离子方程式是
④含硫酸亚铁的药片可治疗缺铁性贫血,可用
您最近一年使用:0次
填空题
|
适中
(0.65)
真题
解题方法
【推荐2】金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数) 。
。
(1) 元素在周期表中位置是
元素在周期表中位置是_______ ,其原子结构示意图_______ ;
(2) 与最活跃的非金属元素A形成化合物D,D的电子式为
与最活跃的非金属元素A形成化合物D,D的电子式为_______ ;
(3)配平用钙线氧脱磷的化学方程式:
___ P +___ FeO +____ CaO
____ Ca3(PO4)2+____ Fe;
(4)将钙线试样溶于稀盐酸,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测Mn+的方法是_______ (用离子方程式表达);
(5)取1.6g钙线试样,与水充分反应,生成224mLH2(标准状况),在向溶液中通入适量的CO2,最多能得到CaCO3_______ g。
 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数) 。
。(1)
 元素在周期表中位置是
元素在周期表中位置是(2)
 与最活跃的非金属元素A形成化合物D,D的电子式为
与最活跃的非金属元素A形成化合物D,D的电子式为(3)配平用钙线氧脱磷的化学方程式:

(4)将钙线试样溶于稀盐酸,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测Mn+的方法是
(5)取1.6g钙线试样,与水充分反应,生成224mLH2(标准状况),在向溶液中通入适量的CO2,最多能得到CaCO3
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】请根据要求回答问题:
(1)合金具有许多优良的性能,我国C919大型飞机上就使用了大量新型材料铝合金。下列物质属于合金的是___________(填选项编号)。
(2)室温下金属钠长期露置在空气中,最终将变为___________(填选项编号)。
(3)为了检验 溶液是否被氧化,可向溶液中加入___________(填选项编号)。
溶液是否被氧化,可向溶液中加入___________(填选项编号)。
(4)冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途。制作冷敷袋可以利用___________(填选项编号)。
(1)合金具有许多优良的性能,我国C919大型飞机上就使用了大量新型材料铝合金。下列物质属于合金的是___________(填选项编号)。
| A.水银 | B.青铜 | C.白银 | D.黄金 |
A. | B. | C. | D.NaOH |
 溶液是否被氧化,可向溶液中加入___________(填选项编号)。
溶液是否被氧化,可向溶液中加入___________(填选项编号)。| A.新制氯水 | B.铁片 | C.KSCN溶液 | D.石蕊试液 |
| A.吸热的物理变化 | B.放热的物理变化 | C.吸热的化学变化 | D.放热的化学变化 |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】铁及其化合物在生产、生活中有着广泛的应用。
(1)钢(一种铁碳合金)是用量最大、用途最广的合金。钢的硬度比纯铁_______ (填“大” 或“小”)。
(2)高铁酸钾(K2FeO4)是一种新型高效、无毒的多功能水处理剂,K2FeO4中Fe的化合价为_______ 。
(3)若一定量的普通铁粉和水蒸气在高温下反应生成44.8 LH2(标准状况),则转移电子的物质的量为_______ mol。
(4)FeSO4可作补血剂,用于治疗缺铁性贫血症。用FeSO4溶液制备Fe(OH)2的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的目的是_______ 。
(5)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,该反应的离子方程式为_______ ,检验反应后的溶液中是否还有三价铁离子的试剂是_______ 。
(6)聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:
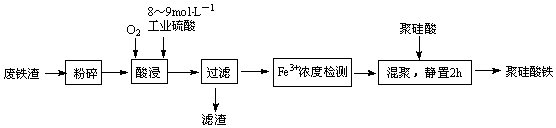
①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为_______ 。
②酸浸时,通入O2的目的是_______ 。
③“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+,再用酸性K2Cr2O7,标准溶液测定Fe2+的量(Cr2O 被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是
被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是_______ 。
(1)钢(一种铁碳合金)是用量最大、用途最广的合金。钢的硬度比纯铁
(2)高铁酸钾(K2FeO4)是一种新型高效、无毒的多功能水处理剂,K2FeO4中Fe的化合价为
(3)若一定量的普通铁粉和水蒸气在高温下反应生成44.8 LH2(标准状况),则转移电子的物质的量为
(4)FeSO4可作补血剂,用于治疗缺铁性贫血症。用FeSO4溶液制备Fe(OH)2的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的目的是
(5)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,该反应的离子方程式为
(6)聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:

①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为
②酸浸时,通入O2的目的是
③“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+,再用酸性K2Cr2O7,标准溶液测定Fe2+的量(Cr2O
 被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是
被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】FeCl3是一种用途比较广泛的铁盐。
(1)印刷电路板是由高分子材料和铜箔复合而成的,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,请写出该反应的离子方程式:___________________ 。
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速率高于铝盐,是城市污水和工业废水处理的高效絮凝剂.实验中制取氢氧化铁胶体的方法是_______ (填序号)。
①向FeCl3溶液中加入足量的NaOH溶液;
②将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体;
③将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色沉淀;
含有Fe3+的盐溶液遇到___________ 溶液时变成红色,我们可以利用这一反应检验Fe3+的存在。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式为2FeCl3+2KI=2FeCl2+I2+2KCl,用双线桥法标出该反应中电子转移的方向和数目__________________________
将一定量的CCl4加入上述反应后的溶液中,振荡、静置后会发现下层液体为__________ 色,再将混合液倒入_________ (填仪器名称)中,可将两层液体分离。
(1)印刷电路板是由高分子材料和铜箔复合而成的,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,请写出该反应的离子方程式:
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速率高于铝盐,是城市污水和工业废水处理的高效絮凝剂.实验中制取氢氧化铁胶体的方法是
①向FeCl3溶液中加入足量的NaOH溶液;
②将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体;
③将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色沉淀;
含有Fe3+的盐溶液遇到
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式为2FeCl3+2KI=2FeCl2+I2+2KCl,用双线桥法标出该反应中电子转移的方向和数目
将一定量的CCl4加入上述反应后的溶液中,振荡、静置后会发现下层液体为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)①在现代半导体工业生产中,常利 腐蚀铜的原理制作印刷线路板,该原理的离子方程式为
腐蚀铜的原理制作印刷线路板,该原理的离子方程式为_______ 。
②氯化铁溶液中同时加入铁粉和铜粉,反应结束后烧杯底部不可能出现的是_______ 。
A.有铁无铜 B.有铜无铁 C.有铁有铜 D.无铁无铜
(2)某同学在 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入
煤油,再于液面下依次加入 滴
滴 溶液和几滴氯水,溶液变红,煤油的作用是
溶液和几滴氯水,溶液变红,煤油的作用是_______ 。
(3)某同学取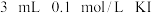 溶液,加入
溶液,加入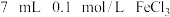 溶液混合。分别取此溶液于
溶液混合。分别取此溶液于 支试管中进行如下实验:
支试管中进行如下实验:
①第一支试管中加入 滴淀粉溶液,溶液显蓝色;
滴淀粉溶液,溶液显蓝色;
②第二支试管中加入 滴
滴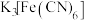 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;
③第三支试管中加入 滴
滴_______ 溶液,溶液变红。
实验②检验的离子可能是_______  填离子符号
填离子符号 ;写出
;写出 与
与 反应的离子方程式
反应的离子方程式_______ 。上述 和
和 溶充分反应后,溶液中
溶充分反应后,溶液中 浓度为
浓度为_______ 。
(4)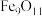 中铁元素形式为
中铁元素形式为 和
和 ,则
,则 和
和 离子质量之比为
离子质量之比为_______ 。
(1)①在现代半导体工业生产中,常利
 腐蚀铜的原理制作印刷线路板,该原理的离子方程式为
腐蚀铜的原理制作印刷线路板,该原理的离子方程式为②氯化铁溶液中同时加入铁粉和铜粉,反应结束后烧杯底部不可能出现的是
A.有铁无铜 B.有铜无铁 C.有铁有铜 D.无铁无铜
(2)某同学在
 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入
煤油,再于液面下依次加入 滴
滴 溶液和几滴氯水,溶液变红,煤油的作用是
溶液和几滴氯水,溶液变红,煤油的作用是(3)某同学取
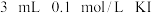 溶液,加入
溶液,加入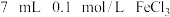 溶液混合。分别取此溶液于
溶液混合。分别取此溶液于 支试管中进行如下实验:
支试管中进行如下实验:①第一支试管中加入
 滴淀粉溶液,溶液显蓝色;
滴淀粉溶液,溶液显蓝色;②第二支试管中加入
 滴
滴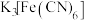 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;③第三支试管中加入
 滴
滴实验②检验的离子可能是
 填离子符号
填离子符号 ;写出
;写出 与
与 反应的离子方程式
反应的离子方程式 和
和 溶充分反应后,溶液中
溶充分反应后,溶液中 浓度为
浓度为(4)
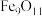 中铁元素形式为
中铁元素形式为 和
和 ,则
,则 和
和 离子质量之比为
离子质量之比为
您最近一年使用:0次

 Fe2(SO4)3 +3SO2↑+6H2O
Fe2(SO4)3 +3SO2↑+6H2O

