如图为元素周期表中部分元素某种性质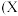 值
值 随原子序数变化的关系。
随原子序数变化的关系。
(1)短周期中原子核外p能级上电子总数与s能级上电子总数相等的元素是______  填元素符号
填元素符号 。
。
(2)同周期,随着原子序数的增大,X值变化趋势为______ 再结合同主族不同元素的X值变化的特点,体现了元素性质的______ 变化规律。
(3)X值较小的元素集中在元素周期表的______  填序号
填序号
A.左下角 右上角
右上角 分界线附近
分界线附近
(4)下列关于元素此性质的说法中正确的是______  填序号
填序号 。
。
A.X值可反映元素最高正化合价的变化规律
B.X值可反映原子在分子中吸引电子的能力
C.X值的大小可用来衡量元素金属性和非金属性的强弱
(5)SiHCl3与水发生的化学反应可认为是广义的水解反应,根据图中数据,该反应的化学方程式为______
 值
值 随原子序数变化的关系。
随原子序数变化的关系。
(1)短周期中原子核外p能级上电子总数与s能级上电子总数相等的元素是
 填元素符号
填元素符号 。
。(2)同周期,随着原子序数的增大,X值变化趋势为
(3)X值较小的元素集中在元素周期表的
 填序号
填序号
A.左下角
 右上角
右上角 分界线附近
分界线附近(4)下列关于元素此性质的说法中正确的是
 填序号
填序号 。
。A.X值可反映元素最高正化合价的变化规律
B.X值可反映原子在分子中吸引电子的能力
C.X值的大小可用来衡量元素金属性和非金属性的强弱
(5)SiHCl3与水发生的化学反应可认为是广义的水解反应,根据图中数据,该反应的化学方程式为
更新时间:2020-02-14 14:30:50
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)碳原子2p亚层上的2个电子不相同的方面是____ (选填序号)。
a.能量 b.电子云形状 c.电子云伸展方向 d.自旋状态
14N 原子与12C原子比,质子数和中子数都更多,但原子半径却更小,请解释__________________ 。
(2)铍(Be)与铝性质相似。
①以下对铍及其化合物的推断肯定不正确的是______ (选填序号)。
a.铍会在浓硫酸中钝化 b.氯化铍固体会发生升华现象
c.氧化铍坚硬难熔 d.铍的熔点低于镁
②写出BeCl2溶液和Na2BeO2溶液混合后反应的离子方程式____________________________ 。
(3)将BeCl2溶液加热蒸干后灼热,再使其熔融,用直流电电解,可得到单质铍和一种单质气体,则该气体的化学式为_______ 。
(4)氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
2Al2O3(s) 4Al(g)+3O2(g) ①
4Al(g)+3O2(g) ①
2C(s)+ O2(g) 2CO(g) ②
2CO(g) ②
2Al(g)+N2(g) 2AlN(s) ③
2AlN(s) ③
试分析反应②对制备AlN的作用______________________________________________ 。
a.能量 b.电子云形状 c.电子云伸展方向 d.自旋状态
14N 原子与12C原子比,质子数和中子数都更多,但原子半径却更小,请解释
(2)铍(Be)与铝性质相似。
①以下对铍及其化合物的推断肯定不正确的是
a.铍会在浓硫酸中钝化 b.氯化铍固体会发生升华现象
c.氧化铍坚硬难熔 d.铍的熔点低于镁
②写出BeCl2溶液和Na2BeO2溶液混合后反应的离子方程式
(3)将BeCl2溶液加热蒸干后灼热,再使其熔融,用直流电电解,可得到单质铍和一种单质气体,则该气体的化学式为
(4)氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
2Al2O3(s)
 4Al(g)+3O2(g) ①
4Al(g)+3O2(g) ① 2C(s)+ O2(g)
 2CO(g) ②
2CO(g) ②2Al(g)+N2(g)
 2AlN(s) ③
2AlN(s) ③试分析反应②对制备AlN的作用
您最近一年使用:0次
【推荐2】黑火药的爆炸反应原理为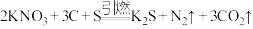 。请回答下列问题:
。请回答下列问题:
(1)基态 原子核外有
原子核外有___________ 种空间运动状态的电子。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为___________ 。
(3)K位于周期表的___________ 区;基态钾离子的电子占据的最高能层符号是___________ 。
(4) 与
与 具有相同的电子构型,
具有相同的电子构型,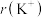 小于
小于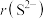 ,原因是
,原因是___________ 。
(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是___________ 。
a.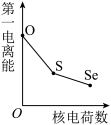 b.
b.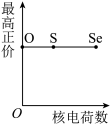 c.
c.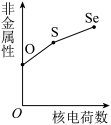 d.
d.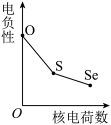
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能 。
。 的Born-Haber循环如图所示。
的Born-Haber循环如图所示。

由图可知, 原子的第二电离能为
原子的第二电离能为___________  ;
; 键的键能为
键的键能为___________  ;氧原子的第一电子亲和能为
;氧原子的第一电子亲和能为___________  ;
; 的晶格能为
的晶格能为___________  。
。
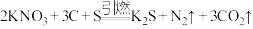 。请回答下列问题:
。请回答下列问题:(1)基态
 原子核外有
原子核外有(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为(3)K位于周期表的
(4)
 与
与 具有相同的电子构型,
具有相同的电子构型,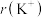 小于
小于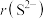 ,原因是
,原因是(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是
a.
 b.
b. c.
c. d.
d.
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能
 。
。 的Born-Haber循环如图所示。
的Born-Haber循环如图所示。
由图可知,
 原子的第二电离能为
原子的第二电离能为 ;
; 键的键能为
键的键能为 ;氧原子的第一电子亲和能为
;氧原子的第一电子亲和能为 ;
; 的晶格能为
的晶格能为 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】Zn、V、Cu、In、S和Se等原子是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
(1)49In的价层电子排布式为_______ 。
(2)Zn、O、S和Se的电负性由大到小的顺序为_______ 。制备荧光材料过程中会产生少量SO 、VO
、VO ,其中V原子采用
,其中V原子采用_______ 杂化,VO 空间结构为
空间结构为_______ ,SO 的空间构型为
的空间构型为_______ 。
(3)C、N、S分别与H形成的简单氢化物中键角最小的是_______ ,其原因是_______ 。
(4)H、C、N、S四种元素可形成硫氰酸(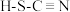 )和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为
)和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为_______ ,异硫氰酸沸点较高,原因是_______ 。
(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用−
表示,与之相反的用− 表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为_______ 。
(1)49In的价层电子排布式为
(2)Zn、O、S和Se的电负性由大到小的顺序为
 、VO
、VO ,其中V原子采用
,其中V原子采用 空间结构为
空间结构为 的空间构型为
的空间构型为(3)C、N、S分别与H形成的简单氢化物中键角最小的是
(4)H、C、N、S四种元素可形成硫氰酸(
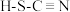 )和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为
)和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用−
表示,与之相反的用− 表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】硅铝合金广泛应用于航空、交通、建筑、汽车等行业。
完成下列填空:
(1)硅原子的结构示意图为___________ ;比较硅铝的原子半径:r(Si)___________ r(Al)(选填:“>”、“<”或“=”)。硅铝合金中的铝与氢氧化钠溶液反应的化学方程式为___________ 。
(2)氟化铝和氯化铝的熔点分别为1040 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是___________ 。
(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为___________ ,推断的依据是___________ 。
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;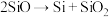 ;
;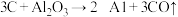
上述反应的最终还原产物为___________ ;当有1mol C参加反应时,转移的电子数目为___________ 。
完成下列填空:
(1)硅原子的结构示意图为
(2)氟化铝和氯化铝的熔点分别为1040
 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;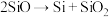 ;
;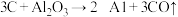
上述反应的最终还原产物为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】氰化钾是一种剧毒物质,贮存和使用时必须注意安全。已知: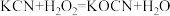 。回答下列问题:
。回答下列问题:
(1) 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为____________________ (用元素符号表示,下同),电负性从大到小的顺序为__________ ,基态氮原子最外层电子排布式为__________ 。
(2)与 互为等电子体的分子为
互为等电子体的分子为__________ (任举一例)。
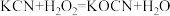 。回答下列问题:
。回答下列问题:(1)
 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为(2)与
 互为等电子体的分子为
互为等电子体的分子为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
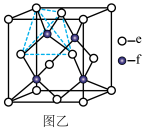
【推荐3】a、b、c、d、e、f分别是H、C、N、Na、Si、Cu六种元素中的其中一种,已知:下图甲表示的是这六种元素单质的熔点高低顺序,其中c、d均是热和电的良导体,f形成的某种单质硬度最大。

回答下列问题:
(1)a、b、f三种元素的电负性从小到大的顺序为___________ (用元素符号表示);
(2)元素b的单质的一个分子中含有___________ 个σ键和___________ 个π键;
(3)c单质分别与氟气和氯气形成化合物甲和乙,则甲的熔点___________ 乙的熔点(填>或<);
(4)元素d的基态原子的价电子排布式为___________ ;
(5)元素c和f可形成化合物丙(丙的晶胞结构如图乙所示),则丙的化学式为___________ ,丙的晶体类型为___________ ,在丙中,每个e原子周围最近的e原子数目为___________ 。

回答下列问题:
(1)a、b、f三种元素的电负性从小到大的顺序为
(2)元素b的单质的一个分子中含有
(3)c单质分别与氟气和氯气形成化合物甲和乙,则甲的熔点
(4)元素d的基态原子的价电子排布式为
(5)元素c和f可形成化合物丙(丙的晶胞结构如图乙所示),则丙的化学式为

您最近一年使用:0次



