开展“三废”综合治理,是防治工业“三废”污染,搞好环境保护的重要途径之一。其中常用方法是将“三废”中有毒有害物转化为无害的物质或有用的产品。
(1)硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理。其主要反应原理:4NO + 4NH3 + O2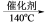 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3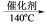 7N2 + 12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
7N2 + 12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
①氨氧混合气的平均相对分子质量为_______ (精确到0.01)。
②尾气中NO的含量为_______ mg/m3。
③要处理5m3的尾气,需要氨氧混合气的体积为_______ L。
(2)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收。
①NaOH溶液的物质的量浓度为_______ mol/L,体积为__________ mL。
②已知反应后溶液中含有0.35mol NaNO2。若将尾气中NO与NO2的平均组成记为NOx,则x=_________ 。
(3)硫酸工业的废水中含质量分数4.9%的硫酸,加入质量分数22.2%的石灰乳,恰好使废水达到排放标准(pH=7),同时又得到副产品石膏(CaSO4·2H2O)。已知按此法处理后每小时可排放达标废水276.5吨,求每小时生产石膏的质量(忽略其他反应且不计过程中损耗)。_____________
(1)硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理。其主要反应原理:4NO + 4NH3 + O2
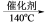 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3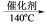 7N2 + 12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
7N2 + 12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。①氨氧混合气的平均相对分子质量为
②尾气中NO的含量为
③要处理5m3的尾气,需要氨氧混合气的体积为
(2)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收。
①NaOH溶液的物质的量浓度为
②已知反应后溶液中含有0.35mol NaNO2。若将尾气中NO与NO2的平均组成记为NOx,则x=
(3)硫酸工业的废水中含质量分数4.9%的硫酸,加入质量分数22.2%的石灰乳,恰好使废水达到排放标准(pH=7),同时又得到副产品石膏(CaSO4·2H2O)。已知按此法处理后每小时可排放达标废水276.5吨,求每小时生产石膏的质量(忽略其他反应且不计过程中损耗)。
2013·上海闵行·二模 查看更多[1]
(已下线)上海市闵行区2013年高考二模化学试题
更新时间:2020-03-29 09:29:43
|
相似题推荐
计算题
|
适中
(0.65)
名校
【推荐1】按要求填空,已知NA为阿伏加德罗常数的数值。
(1)标准状况下,2.24LCl2中有_______ 个氯原子。
(2)含0.4molAl3+的Al2(SO4)3中所含的 的物质的量是
的物质的量是_______ 。
(3)阻燃剂碱式碳酸铝镁中OH-与 质量之比为51:300,则这两种离子的物质的量之比为
质量之比为51:300,则这两种离子的物质的量之比为_______ 。
(4)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是_______ 。
(5)标准状况下,3.4gNH3的体积为_______ ;它与标准状况下_______ LH2S含有相同数目的氢原子。
(6)10.8gR2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为_______ ;R元素名称是_______ 。
(7)将10mL1.00mol/LNa2CO3溶液与10mL1.00mol/LCaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为_______ ,混和溶液中Cl-的物质的量_______ (忽略混合前后溶液体积的变化)。
(8)a个X原子的总质量为bg,则X的相对原子质量可以表示为_______
(9)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______ 。
(1)标准状况下,2.24LCl2中有
(2)含0.4molAl3+的Al2(SO4)3中所含的
 的物质的量是
的物质的量是(3)阻燃剂碱式碳酸铝镁中OH-与
 质量之比为51:300,则这两种离子的物质的量之比为
质量之比为51:300,则这两种离子的物质的量之比为(4)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是
(5)标准状况下,3.4gNH3的体积为
(6)10.8gR2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为
(7)将10mL1.00mol/LNa2CO3溶液与10mL1.00mol/LCaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为
(8)a个X原子的总质量为bg,则X的相对原子质量可以表示为
(9)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】125g黄铜(铜锌合金)粉末可以跟250g硫酸溶液恰好完全反应,称得未溶物质量为92.5g。(可能涉及到元素的相对原子质量:Zn65 H1 S32 O16 Cu64)
(1)写出该反应的化学方程式_______ 。
(2)若将反应后的溶液蒸发1g水,温度降到室温,溶液正好饱和。求在室温时硫酸锌的溶解度_______ 。
(1)写出该反应的化学方程式
(2)若将反应后的溶液蒸发1g水,温度降到室温,溶液正好饱和。求在室温时硫酸锌的溶解度
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】(1)1mol H2SO4中约含有______ 个H2SO4,______ mol H,______ mol O。
(2)9.03×1023个CO2的物质的量是______ mol,在标准状况下的体积是______ L,质量是_____ 克。
(3)在100mL 2mol/LH2SO4溶液中,H2SO4的质量是______ 克。H+的物质的量浓度为_______ 。
(4)质量分数为36.5%、密度为1.18g/cm3的浓盐酸中HCl的物质的量浓度为_____________ 。
(2)9.03×1023个CO2的物质的量是
(3)在100mL 2mol/LH2SO4溶液中,H2SO4的质量是
(4)质量分数为36.5%、密度为1.18g/cm3的浓盐酸中HCl的物质的量浓度为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】取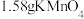 配成
配成 酸性溶液,往溶液中加入
酸性溶液,往溶液中加入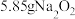 粉末,观察到
粉末,观察到 溶液紫色褪去,同时产生一种常见的无色气体。
溶液紫色褪去,同时产生一种常见的无色气体。
(1)充分反应后溶液中 的浓度为
的浓度为___________ (假设溶液体积不变).
(2)产生的气体体积为__________________  (标准状况下)。
(标准状况下)。
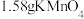 配成
配成 酸性溶液,往溶液中加入
酸性溶液,往溶液中加入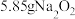 粉末,观察到
粉末,观察到 溶液紫色褪去,同时产生一种常见的无色气体。
溶液紫色褪去,同时产生一种常见的无色气体。(1)充分反应后溶液中
 的浓度为
的浓度为(2)产生的气体体积为
 (标准状况下)。
(标准状况下)。
您最近一年使用:0次
【推荐2】某(NH4)2CO3和(NH4)2SO4的固体混合物含氮量为23.3%。
(1)取9.0g该混合物,加入足量浓NaOH溶液,加热,产生的气体在标准状况下体积为________________ L(保留2位小数)。
(2)向上述反应后的混合溶液中再加入足量稀盐酸,产生560mL气体(标准状况)。列式计算原固体混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比。________________
(1)取9.0g该混合物,加入足量浓NaOH溶液,加热,产生的气体在标准状况下体积为
(2)向上述反应后的混合溶液中再加入足量稀盐酸,产生560mL气体(标准状况)。列式计算原固体混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比。
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐3】取部分被氧化的铁粉若干克,将其溶于 200mL 某浓度的硝酸溶液中,恰好完全反应,并释放出448mL NO(标准状况下)。将所得溶液平均分为两份,向第一份溶液中加入足量氢氧化钠溶液,过滤、 洗涤、灼烧,得到 8.00g 红棕色固体;向第二份溶液中通入 672mL Cl2(标准状况下),恰好完全反应(不考虑氯气的溶解)。试计算:
(1)样品和硝酸反应后的溶液中,n(Fe2+) : n(Fe3+) =_______ 。
(2)原硝酸溶液的浓度 c =_______ mol/L。
(1)样品和硝酸反应后的溶液中,n(Fe2+) : n(Fe3+) =
(2)原硝酸溶液的浓度 c =
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】蛋白质在一定条件下与浓硫酸反应可转化为硫酸铵,后者在浓氢氧化钠溶液和水蒸气作用下,其中的氮元素可转化为氨放出。现用30.0mL牛奶进行上述实验,将牛奶中蛋白质里的氮元素完全转化成氨,再用50.0mL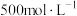 硫酸溶液吸收放出的氨,剩余的酸用38.0mL
硫酸溶液吸收放出的氨,剩余的酸用38.0mL 氢氧化钠溶液可恰好完全中和。
氢氧化钠溶液可恰好完全中和。
(1)30.0mL牛奶中共含有_______ 克氮?
(2)如果牛奶中蛋白质含氮16%(质量分数),则牛奶中蛋白质的质量分数是______ ?(已知牛奶的密度是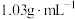 )
)
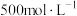 硫酸溶液吸收放出的氨,剩余的酸用38.0mL
硫酸溶液吸收放出的氨,剩余的酸用38.0mL 氢氧化钠溶液可恰好完全中和。
氢氧化钠溶液可恰好完全中和。(1)30.0mL牛奶中共含有
(2)如果牛奶中蛋白质含氮16%(质量分数),则牛奶中蛋白质的质量分数是
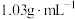 )
)
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】(1)配制500mL 3.6mol/L 的稀H2SO4所需18 mol/L的浓H2SO4的体积为________ mL。
(2)常温下,将0.1 mol/L的NH4Cl溶液与0.1 mol/L的氨水溶液等体积混合,所得混合液的pH=7,则c(NH4+)=________ mol/L,c(Cl-)=________ mol/L。
(2)常温下,将0.1 mol/L的NH4Cl溶液与0.1 mol/L的氨水溶液等体积混合,所得混合液的pH=7,则c(NH4+)=
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】中学化学中有许多与氮有关的反应。阅读材料,回答问题。
(1)氨气和氧气在催化剂存在下的反应方程式为4NH3十5O2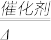 4NO+6H2O,完成下列计算:
4NO+6H2O,完成下列计算:
①生成1molNO消耗氧气的体积为_________ L(标准状况)。
②5 mol NH3和5 molO2反应生成4 molNO,过量的氨溶于产物水中成为氨水,所得氨水的密度为0.75g/mL,则该氨水的物质的量浓度为_____ mol/L。
③如果没有催化剂,氨氧化生成NO的同时也生成氮气:4NH3+3O2=2N2+6H2O。若4 mol NH3和4 molO2恰好完全反应,则产物气体中NO的物质的量为_____ mol。
(2)已知真空管中反应2NO2 N2O4,现向一真空管中充入4L标况下的NO2气体:
N2O4,现向一真空管中充入4L标况下的NO2气体:
①若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为______ g/mol(保留一位小数)。
②将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为_______ L。
(3)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O
现有一NO与NO2的混合气体,将其通入50mL 2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3-0.02mol。
①所得溶液中NaNO2的物质的量为____ mol;②混合气体中V(NO):V(NO2)=________ 。
(1)氨气和氧气在催化剂存在下的反应方程式为4NH3十5O2
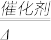 4NO+6H2O,完成下列计算:
4NO+6H2O,完成下列计算:①生成1molNO消耗氧气的体积为
②5 mol NH3和5 molO2反应生成4 molNO,过量的氨溶于产物水中成为氨水,所得氨水的密度为0.75g/mL,则该氨水的物质的量浓度为
③如果没有催化剂,氨氧化生成NO的同时也生成氮气:4NH3+3O2=2N2+6H2O。若4 mol NH3和4 molO2恰好完全反应,则产物气体中NO的物质的量为
(2)已知真空管中反应2NO2
 N2O4,现向一真空管中充入4L标况下的NO2气体:
N2O4,现向一真空管中充入4L标况下的NO2气体:①若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为
②将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为
(3)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O
现有一NO与NO2的混合气体,将其通入50mL 2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3-0.02mol。
①所得溶液中NaNO2的物质的量为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】请回答下列问题:
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。试写出氨气和二氧化氮在一定条件下反应的化学方程式:_______ ,反应中氧化剂是_______ ,还原剂是_____ 。
(2)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下: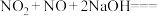
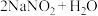 、
、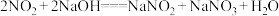 。现有
。现有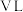 某NaOH溶液,能完全吸收由
某NaOH溶液,能完全吸收由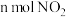 和
和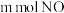 组成的大气污染物。
组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为______  。
。
②若所得溶液中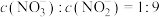 ,则原混合气体中
,则原混合气体中 和NO的物质的量之比
和NO的物质的量之比
_______ 。
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。试写出氨气和二氧化氮在一定条件下反应的化学方程式:
(2)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
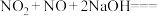
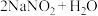 、
、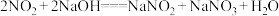 。现有
。现有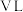 某NaOH溶液,能完全吸收由
某NaOH溶液,能完全吸收由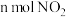 和
和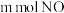 组成的大气污染物。
组成的大气污染物。①所用烧碱溶液的物质的量浓度至少为
 。
。②若所得溶液中
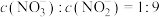 ,则原混合气体中
,则原混合气体中 和NO的物质的量之比
和NO的物质的量之比
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】烟气中NOx是NO和NO2的混合物(不含N2O4);
(1)根据废气排放标准,1m3烟气最高允许含400mgNOx.若NOx中NO质量分数为0.85,则lm3烟气中最高允许含NO___________ L(标准状况,保留2位小数);
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度l.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为_______ mol/L(保留2位小数);
(3)已知:
NO+NO2+Na2CO3→2NaNO2+CO2 ①
2NO2+Na2CO3→NaNO2+NaNO3+CO2 ②
1m3含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收.若吸收率为80%,吸收后的烟气______ 排放标准(填“符合”或“不符合”),理由:___________ ;
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3→3NO2+H2O当烟气中n(NO):n(NO2)=2:3时,吸收率最高;
lm3烟气含2000mgNOx,其中n(NO):n(NO2)=9:1;
计算:
(i)为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数)__________ ;
(ii)1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量_____________ (假设上述吸收反应中,反应①比反应②迅速.计算结果保留1位小数)。
(1)根据废气排放标准,1m3烟气最高允许含400mgNOx.若NOx中NO质量分数为0.85,则lm3烟气中最高允许含NO
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度l.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为
(3)已知:
NO+NO2+Na2CO3→2NaNO2+CO2 ①
2NO2+Na2CO3→NaNO2+NaNO3+CO2 ②
1m3含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收.若吸收率为80%,吸收后的烟气
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3→3NO2+H2O当烟气中n(NO):n(NO2)=2:3时,吸收率最高;
lm3烟气含2000mgNOx,其中n(NO):n(NO2)=9:1;
计算:
(i)为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数)
(ii)1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量
您最近一年使用:0次



