有学者提出“铁丝燃烧绕成螺旋状,是为了防止燃烧点因迅速上升到集气瓶内氧气低浓度区而熄灭”。据此,化学学习小组的同学决定对铁丝在氧气中燃烧进行更深入的探究。
活动一:探究铁丝燃烧时长的影响因素
[实验1]如图1所示,从同一长铁丝上分别截取3根长度相同的铁丝,将1根拉直、另2根绕成直径大小不同的螺旋状,下端系上燃着的小木条进行燃烧实验。每种形状的铁丝平行测量3次,所测得的实验数据如图2所示。______ ,故进行该实验时,宜选择容积为______ (填“125”或“250”)mL的集气瓶更容易成功。
(2)实验中发现不管铁丝形状如何,其燃烧时长均在曲线附近,说明燃烧时长与铁丝是否绕成螺旋状_____ (填“有关”或“无关”)。
(3)实验时,3根铁丝均要完全伸入集气瓶中,原因是______ 。
(4)分析图2可知,铁丝在氧气中剧烈燃烧的时长与集气瓶内氧气的起始浓度的关系是_______ 。
活动二:探究铁丝的含碳量与火星四射的关系
[实验2]取粗细相同、含碳量不同的细铁丝,分别在氧气中燃烧,记录实验现象如表。
(5)实验中_______ (填“能”或“不能”)以产生火星四射的现象作为衡量铁丝是否燃烧的唯一标志。
反思与拓展
(6)理论上,铁丝燃烧后质量会增加。分析多组实验发现,铁丝未发生熔断,但反应前铁丝质量与反应后差别不大,其原因可能是________ 。
(7)冷烟花由多种金属粉末制成,燃放时火花飞舞,其喷射口处温度可高达700-800℃,火花喷出后温度迅速降低,距喷射口50mm处,温度降至约40℃,所以俗称冷烟花。燃放冷烟花的正确做法是_______ 。
活动一:探究铁丝燃烧时长的影响因素
[实验1]如图1所示,从同一长铁丝上分别截取3根长度相同的铁丝,将1根拉直、另2根绕成直径大小不同的螺旋状,下端系上燃着的小木条进行燃烧实验。每种形状的铁丝平行测量3次,所测得的实验数据如图2所示。
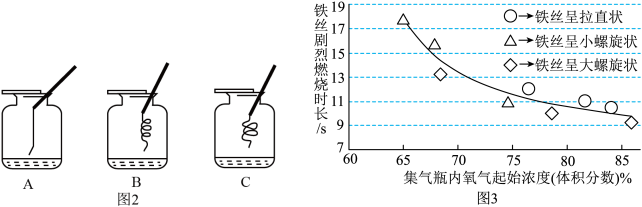
(2)实验中发现不管铁丝形状如何,其燃烧时长均在曲线附近,说明燃烧时长与铁丝是否绕成螺旋状
(3)实验时,3根铁丝均要完全伸入集气瓶中,原因是
(4)分析图2可知,铁丝在氧气中剧烈燃烧的时长与集气瓶内氧气的起始浓度的关系是
活动二:探究铁丝的含碳量与火星四射的关系
[实验2]取粗细相同、含碳量不同的细铁丝,分别在氧气中燃烧,记录实验现象如表。
| 铁丝含碳量 | 0% | 0.2% | 0.38% |
| 实验现象 | 无火星,燃烧处熔成小球 | 有短暂火星四射现象 | 火星四射,现象明显 |
(5)实验中
反思与拓展
(6)理论上,铁丝燃烧后质量会增加。分析多组实验发现,铁丝未发生熔断,但反应前铁丝质量与反应后差别不大,其原因可能是
(7)冷烟花由多种金属粉末制成,燃放时火花飞舞,其喷射口处温度可高达700-800℃,火花喷出后温度迅速降低,距喷射口50mm处,温度降至约40℃,所以俗称冷烟花。燃放冷烟花的正确做法是
更新时间:2024-05-23 09:39:47
|
相似题推荐
科学探究题
|
较难
(0.4)
解题方法
【推荐1】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格):
【提出问题】化学反应前后各物质的质量总和是否相等?
【查阅资料】氢氧化钠(NaOH)溶液可以吸收二氧化碳气体。
【猜想与假设】猜想1:不相等猜想2:相等
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
【反思评价】究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡是有气体生成或参加的反应一定要在___________ 中进行。
【优化装置】同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是____________ (填序号),从另外两种装置中任选一种指出其不足______________ 。
【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想二正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论是:_____________ 的各物质的质量总和等于反应后生成的各物质的质量总和。
【解释应用】解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由__________ 种元素组成。
【提出问题】化学反应前后各物质的质量总和是否相等?
【查阅资料】氢氧化钠(NaOH)溶液可以吸收二氧化碳气体。
【猜想与假设】猜想1:不相等猜想2:相等
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
| 甲组 | 乙组 | |
| 实验方案 (反应后略) | 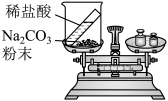 | 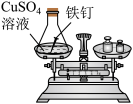 |
| 实验现象 | 有气泡产生,天平指针向右偏转 | 现象: |
| 结论 | 猜想1正确 | 猜想2正确,反应的化学方程式: |
【优化装置】同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是

【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想二正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论是:
【解释应用】解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】质量守恒定律的发现,对化学的发展做出重要贡献。科学家和同学们进行如下探究:
【提出问题】化学反应中,参加反应的物质质量总和与生成物的质量总和是否相等?
【进行实验】
实验一:1756年,俄国科学家罗蒙诺索夫,把锡放在密闭容器里锻烧,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。
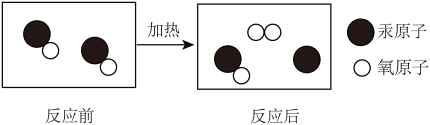
实验二:1774年,拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气。
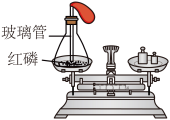
实验三:同学们利用红磷燃烧进行实验,装置如图所示,结果反应前后质量相等。
【实验分析】
(1)实验一中若放入锡的质量为m克,密闭容器内氧气的质量为n克,则生成的氧化锡的质量可能______ 克;
A.等于m+n B.大于m+n C.小于m+n
(2)实验二中发生反应的微观图示如图,该反应中没有发生变化的微粒名称是______ ;
(3)实验三中点燃红磷后气球的变化情况为______ ;若锥形瓶底部不铺细沙,会导致______ ;
【交流讨论】
(4)下列关于上述三个实验的共同点描述中,正确的是______ ;
A.三个实验中涉及的反应均属于分解反应
B.三个实验变化前后原子的种类、数目、质量都不变
C.三个实验中所用的药品均需稍过量,否则影响实验结果
【拓展迁移】
(5)已知氢气在氯气中燃烧,可用化学方程式表示为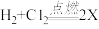 ,则X的化学式为
,则X的化学式为______ ;
(6)如图是某反应中固体物质质量变化情况,下列与之相符的化学反应是______ ;
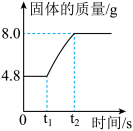
A.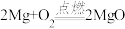 B.
B. C.
C.

【提出问题】化学反应中,参加反应的物质质量总和与生成物的质量总和是否相等?
【进行实验】
实验一:1756年,俄国科学家罗蒙诺索夫,把锡放在密闭容器里锻烧,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。
实验二:1774年,拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气。
实验三:同学们利用红磷燃烧进行实验,装置如图所示,结果反应前后质量相等。
【实验分析】
(1)实验一中若放入锡的质量为m克,密闭容器内氧气的质量为n克,则生成的氧化锡的质量可能
A.等于m+n B.大于m+n C.小于m+n
(2)实验二中发生反应的微观图示如图,该反应中没有发生变化的微粒名称是

(3)实验三中点燃红磷后气球的变化情况为
【交流讨论】
(4)下列关于上述三个实验的共同点描述中,正确的是
A.三个实验中涉及的反应均属于分解反应
B.三个实验变化前后原子的种类、数目、质量都不变
C.三个实验中所用的药品均需稍过量,否则影响实验结果
【拓展迁移】
(5)已知氢气在氯气中燃烧,可用化学方程式表示为
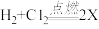 ,则X的化学式为
,则X的化学式为(6)如图是某反应中固体物质质量变化情况,下列与之相符的化学反应是

A.
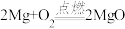 B.
B. C.
C.
您最近一年使用:0次
科学探究题
|
较难
(0.4)
【推荐3】某固体粉末由Mg、MgO、Mg (OH)2中的一种或几种组成。某化学小组为了探究该固体粉末的成分,设计如图所示的装置(固定装置省略)。
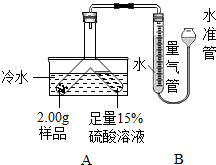
【信息资料】(1))本实验条件下,氢气密度为0.09g/L。
(2)Mg,MgO,Mg(OH)2 均能与硫酸反应
(3)MgSO4+2NaOH===Na2SO4+Mg(OH)2↓
【实验过程】
步骤Ⅰ:检查装置气密性,装入药品并连接仪器。
步骤Ⅱ:倾斜Y形管,使样品充分反应,测的生成气体的体积为55.6mL。
步骤Ⅲ:拆下装置,往Y形管内残余液中加入氢氧化钠溶液,至不再生成沉淀。经过滤、洗涤和干燥后,称得沉淀质量为2.90g。
【回答问题】
(1)该套装置气密性的检验方法是____________________ 。
(2)用冷水浴的原因是___________
(3)①使样品与硫酸充分反应的正确操作是_________ (填标号)。
A.硫酸溶液转移到样品中 B.样品转移到硫酸溶液中
②判断样品完全反应的现象是___________________________ 。
③样品与硫酸反应中可能存在属置换反应的反应方程式为___________
(4)根据实验结果分析:
①通过步骤Ⅱ推断,样品中一定含有的物质是______________ 。步骤Ⅲ中有沉淀生成的方程式为MgSO4+2NaOH===Na2SO4+Mg(OH)2↓,经计算,样品中镁元素的总质量为_____________ 克 。
②结论:该样品中的成分是________________________ 。
【反思】
(5)该化学小组同学经过讨论得出以下结论,正确的是_________ (填标号)。
A.利用该实验方案,能计算出样品中各物质的质量
B.实验前可通过样品的质量估算硫酸溶液的质量,确保样品完全反应
C.仅称量步骤Ⅱ中Y形管内药品减轻的质量,即能计算出样品中各物质的质量
(6)从该实验中得出制取硫酸镁的三种方法,得出这三个反应中消耗等量等浓度的硫酸,生成的硫酸镁质量_______________ (相等或不同)
(7)若本实验中把硫酸换为浓盐酸,你的看法是_________

【信息资料】(1))本实验条件下,氢气密度为0.09g/L。
(2)Mg,MgO,Mg(OH)2 均能与硫酸反应
(3)MgSO4+2NaOH===Na2SO4+Mg(OH)2↓
【实验过程】
步骤Ⅰ:检查装置气密性,装入药品并连接仪器。
步骤Ⅱ:倾斜Y形管,使样品充分反应,测的生成气体的体积为55.6mL。
步骤Ⅲ:拆下装置,往Y形管内残余液中加入氢氧化钠溶液,至不再生成沉淀。经过滤、洗涤和干燥后,称得沉淀质量为2.90g。
【回答问题】
(1)该套装置气密性的检验方法是
(2)用冷水浴的原因是
(3)①使样品与硫酸充分反应的正确操作是
A.硫酸溶液转移到样品中 B.样品转移到硫酸溶液中
②判断样品完全反应的现象是
③样品与硫酸反应中可能存在属置换反应的反应方程式为
(4)根据实验结果分析:
①通过步骤Ⅱ推断,样品中一定含有的物质是
②结论:该样品中的成分是
【反思】
(5)该化学小组同学经过讨论得出以下结论,正确的是
A.利用该实验方案,能计算出样品中各物质的质量
B.实验前可通过样品的质量估算硫酸溶液的质量,确保样品完全反应
C.仅称量步骤Ⅱ中Y形管内药品减轻的质量,即能计算出样品中各物质的质量
(6)从该实验中得出制取硫酸镁的三种方法,得出这三个反应中消耗等量等浓度的硫酸,生成的硫酸镁质量
(7)若本实验中把硫酸换为浓盐酸,你的看法是
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐1】小金同学分别用向上排空气法和排水法各收集一瓶氧气,然后进行铁丝燃烧的实验,发现燃烧现象不同,于是对铁丝燃烧与氧气浓度的关系进行了探究。
[进行实验]取5根相同的铁丝(直径0.6mm),卷成相同的螺旋状后,分别在氧气体积分数不同的集气瓶中进行实验,实验记录如下
(1)铁丝燃烧的文字表达式为______ 。
(2)通过这组探究实验,可得出的结论______ 。
(3)要研究铁丝的粗细对燃烧现象的影响,下列实验能达到目的是______ 。
A 在同一瓶氧气中,先后进行不同粗、细铁丝的燃烧实验
B 在两瓶不同浓度的氧气中,分别同时进行粗、细铁丝的燃烧实验
C 在两瓶相同浓度的氧气中,分别进行粗、细铁丝的燃烧实验
[反思与评价]对氧气纯度要求较高的实验应采取______ 收集氧气。
[观察与思考] 某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。该小组同学进行了如下探究。
(1)探究一:蜡烛燃烧产生火焰的原因是什么?

点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由______ (填“固态”或“气态”)物质燃烧形成的。
(2)探究二:物质燃烧产生火焰的根本原因是什么?
[资料]
由上表可知:物质燃烧能否产生火焰与其______ (填“熔点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时,______ (填“有"或“没有")火焰产生。
(3)木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时会产生火焰,其原因可能是______ 。
获得结论:______ 。
[进行实验]取5根相同的铁丝(直径0.6mm),卷成相同的螺旋状后,分别在氧气体积分数不同的集气瓶中进行实验,实验记录如下
| 实验次数 | 氧气的体积分数% | 实验现象 |
| 第一次 | 90% | 燃烧剧烈,火星四射,燃烧时间长,实验成功 |
| 第二次 | 80% | 燃烧现象与90%的相比没有明显差异,实验成功 |
| 第三次 | 70% | 燃烧比80%的弱,燃烧时间比80%的短,实验成功 |
| 第四次 | 60% | 燃烧比70%的弱,燃烧时间更短,实验成功 |
| 第五次 | 50% | 铁丝没有燃烧 |
(1)铁丝燃烧的文字表达式为
(2)通过这组探究实验,可得出的结论
(3)要研究铁丝的粗细对燃烧现象的影响,下列实验能达到目的是
A 在同一瓶氧气中,先后进行不同粗、细铁丝的燃烧实验
B 在两瓶不同浓度的氧气中,分别同时进行粗、细铁丝的燃烧实验
C 在两瓶相同浓度的氧气中,分别进行粗、细铁丝的燃烧实验
[反思与评价]对氧气纯度要求较高的实验应采取
[观察与思考] 某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。该小组同学进行了如下探究。
(1)探究一:蜡烛燃烧产生火焰的原因是什么?

点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由
(2)探究二:物质燃烧产生火焰的根本原因是什么?
[资料]
| 物质 | 熔点/℃ | 沸点/℃ | 燃烧时温度/℃ |
| 石蜡 | 50~70 | 300~550 | 约600 |
| 铁 | 1535 | 2750 | 约1800 |
| 钠 | 97.8 | 883 | 约1400 |
由上表可知:物质燃烧能否产生火焰与其
(3)木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时会产生火焰,其原因可能是
获得结论:
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】同学们在学习完氧气的性质后,知道了“氧气能使带火星的木条复燃”,在此基础上,同学们提出了以下问题,并逐一进行了探究。
(1)【问题一】带火星的木条复燃能否证明氧气是纯氧?
【进行实验】同学们用数字化实验探测仪进行实验 如图
如图 ,并获得了一系列数据。
,并获得了一系列数据。
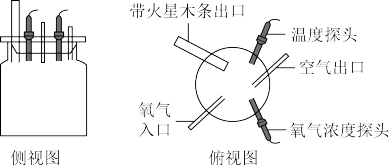
【收集证据】④号集气瓶内的氧气浓度可能是_____ 。
【实验结论】_____ 。
【反思与评价】分析以上数据可知欲收集瓶较为纯争的氧气最好的收集方法是_____ 。
(2)【问题二】铁丝在氧气中的燃烧与氧气浓度和铁丝粗细有关系吗?
【收集证据】⑤号实验中细铁丝燃烧的完整实验现象是_____ 。
【实验解释】有关反应的化学方程式是_____ ,实验操作中,在集气瓶底部放少量水的目的是_____ 。
【实验结论】Ⅰ 氧气浓度越大,铁丝燃烧越
氧气浓度越大,铁丝燃烧越_____ 。Ⅱ_____ 。
【表达与交流】在完成铁丝燃烧的实验时,为保证实验成功需注意的一项实验操作是_____ 。
(1)【问题一】带火星的木条复燃能否证明氧气是纯氧?
【进行实验】同学们用数字化实验探测仪进行实验
 如图
如图 ,并获得了一系列数据。
,并获得了一系列数据。| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ |
| 氧气浓度(体积分数) | 25% | 35% | 45% | … | 65% |
| 带火星木条情况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |

【收集证据】④号集气瓶内的氧气浓度可能是
【实验结论】
【反思与评价】分析以上数据可知欲收集瓶较为纯争的氧气最好的收集方法是
(2)【问题二】铁丝在氧气中的燃烧与氧气浓度和铁丝粗细有关系吗?
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 氧气浓度(体积分数) | 34% | 47% | 60% | 73% | 86% |
| 直径0.2mm的细铁丝 | 不燃烧 | 稍有燃烧 | 剧烈燃烧 | 剧烈燃烧 | 剧烈燃烧 |
| 直径0.5mm的粗铁丝 | 不燃烧 | 不燃烧 | 不燃烧 | 稍有燃烧 | 剧烈燃烧 |
【实验解释】有关反应的化学方程式是
【实验结论】Ⅰ
 氧气浓度越大,铁丝燃烧越
氧气浓度越大,铁丝燃烧越【表达与交流】在完成铁丝燃烧的实验时,为保证实验成功需注意的一项实验操作是
您最近一年使用:0次
科学探究题
|
较难
(0.4)
【推荐3】化学小组在做“铁在氧气中燃烧”的实验时,进行了一系列探究活动。
探究一:“火星四射”的现象与铁丝含碳量的关系:
探究二:铁丝燃烧所需氧气的体积分数的最低值。
取长短相同,直径均为0.38mm的铁丝,分别在体积分数为90%,70%,60%,55%的O2中实验。
(1)实验现象如下:
(2)用下图装置收集一瓶含氧气的体积分数约为60%的气体。在150mL集气瓶里装满水,塞紧橡胶塞并关闭活塞b,打开活塞a通入氧气,当量筒内收集到______ mL的水后,立即关闭活塞a并打开活塞b通入空气,即可得到含氧气的体积分数约为60%的气体(提示:空气中氧气的体积分数约为五分之一)
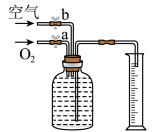
(3)通过上述实验可知,铁丝燃烧所需氧气的最低体积分数为______ 。
(4)小明指出上述关于铁丝燃烧所需氧气最低浓度的结论不合理,理由是______ 。
探究一:“火星四射”的现象与铁丝含碳量的关系:
| 实验操作 | 实验现象 | 实验结论 |
| 实验1:取直径0.38mm的纯铁丝在氧气中燃烧 | 无火星,生成较少黑色固体 | 铁丝燃烧的化学方程式是 |
| 实验2:取直径0.38mm,含碳0.1%的铁丝在氧气中燃烧 | 较少火星,生成较少黑色固体 | |
| 实验3:取直径 | 明显的火星四射,生成较多黑色固体 |
取长短相同,直径均为0.38mm的铁丝,分别在体积分数为90%,70%,60%,55%的O2中实验。
(1)实验现象如下:
| 氧气含量 | 90% | 70% | 60% | 55% |
| 实验现象 | 燃烧剧烈,燃烧时间长,效果好 | 燃烧比70%弱,燃烧时间更短,实验成功 | 难以燃烧,只是发红 |

(3)通过上述实验可知,铁丝燃烧所需氧气的最低体积分数为
(4)小明指出上述关于铁丝燃烧所需氧气最低浓度的结论不合理,理由是
您最近一年使用:0次
科学探究题
|
较难
(0.4)
【推荐1】小雨同学在体育课上腿部擦伤,医务室的大夫在她伤口上涂了医用过氧化氢溶液,小雨看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?
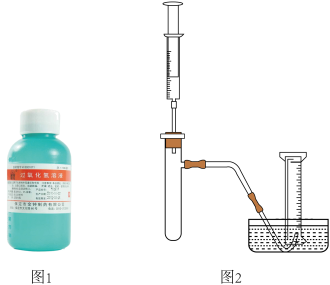
(1)小雨同学准备用如图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气。记录2分钟收集的气体体积。
I、请写出实验室过氧化氢分解制氧气的文字表达式:______ 。
Ⅱ、小雨同学为了检验该气体是否是氧气,把导气管从水中取出,将带火星的木条放在导气管口处,观察到______ ,说明生成的气体是氧气。
(2)小雨查阅了相关资料,并进行了探究实验:
【查阅资料】
I、过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
Ⅱ、温度对化学反应的快慢有影响,人体正常体温是37℃。
【提出猜想】
猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
【进行实验】
【实验反思】小雨反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
I、你认为小雨的实验中所用过氧化氢溶液除浓度相同外,体积应该是______ mL。
Ⅱ、通过这些数据,你能得出的新结论是______ 。

(1)小雨同学准备用如图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气。记录2分钟收集的气体体积。
I、请写出实验室过氧化氢分解制氧气的文字表达式:
Ⅱ、小雨同学为了检验该气体是否是氧气,把导气管从水中取出,将带火星的木条放在导气管口处,观察到
(2)小雨查阅了相关资料,并进行了探究实验:
【查阅资料】
I、过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
Ⅱ、温度对化学反应的快慢有影响,人体正常体温是37℃。
【提出猜想】
猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
【进行实验】
序号 | 实验步骤 | 实验现象 | 实验结论 |
1 | 分两次进行实验,均注入等体积过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5mL | |
2 | 分两次进行实验: 第一次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5mL过氧化氢溶液; 第二次 | 第一次,量筒中2分钟收集到的气体体积为 第二次,量筒中2分钟收集到的气体体积为5mL | 过氧化氢分解加快是因为过氧化氢酶的作用 |
加入过氧化氢酶 | 不加过氧化氢酶 | |||||
反应温度/℃ | 25 | 37 | 42 | 25 | 37 | 42 |
收集到气体体积/mL | 39 | 56 | 34 | 5 | 5 | 5 |
Ⅱ、通过这些数据,你能得出的新结论是
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】84消毒液、H2O2溶液都是常用消毒剂,兴趣小组对两种消毒剂进行了如下探究活动。
(查阅资料)84消毒液的有效成分是次氯酸钠(化学式为NaClO)。
(实验1)
(1)取少量84消毒液于试管中,滴加H2O2溶液,发现有大量气泡产生,然后________ (填写实验操作和现象),证明产生的气体是氧气。单独取少量H2O2溶液于试管中,加热,也有大量气泡产生,该反应的符号表达式为________ 。
(提出问题)在上述反应中,NaClO的作用是什么?
(作出猜想)
(2)猜想一:作反应物,NaClO与H2O2溶液发生化学反应;猜想二:作_________ ,类似分解H2O2溶液制氧气时MnO2的作用。
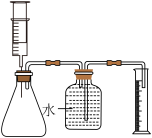
(实验2)按如图所示组装实验装置进行实验。________ 。
向锥形瓶中加入30mL84消毒液,注射器中吸入25mLH2O2溶液。
(4)将注射器中的H2O2溶液平均分5次推入锥形瓶中:每次推入H2O2溶液,待不再产生气泡后,记录收集气体的总体积(忽略其他因素对测量结果造成的影响)见表。
①表中的数据x=_______ 。
②分析表中数据得出“猜想一正确”,其依据是_______ 。
(拓展反思)
(5)75%酒精、过氧乙酸等也可作消毒剂。在使用各种消毒剂时,要考虑它们的性质。生活中下列使用消毒剂的做法正确的是_______ 。
(查阅资料)84消毒液的有效成分是次氯酸钠(化学式为NaClO)。
(实验1)
(1)取少量84消毒液于试管中,滴加H2O2溶液,发现有大量气泡产生,然后
(提出问题)在上述反应中,NaClO的作用是什么?
(作出猜想)
(2)猜想一:作反应物,NaClO与H2O2溶液发生化学反应;猜想二:作
(实验2)按如图所示组装实验装置进行实验。
向锥形瓶中加入30mL84消毒液,注射器中吸入25mLH2O2溶液。
(4)将注射器中的H2O2溶液平均分5次推入锥形瓶中:每次推入H2O2溶液,待不再产生气泡后,记录收集气体的总体积(忽略其他因素对测量结果造成的影响)见表。
| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
| 收集气体的总体积/mL | 140 | 280 | 365 | x | 375 |
②分析表中数据得出“猜想一正确”,其依据是
(拓展反思)
(5)75%酒精、过氧乙酸等也可作消毒剂。在使用各种消毒剂时,要考虑它们的性质。生活中下列使用消毒剂的做法正确的是
| A.不同的消毒剂可随意混合使用 | B.使用75%酒精消毒应远离明火,防止火灾 |
| C.使用84消毒液的浓度越高越好 | D.84消毒液、75%酒精等消毒剂均应密封保存 |
您最近一年使用:0次
科学探究题
|
较难
(0.4)
【推荐3】对比实验是化学中行之有效的学习方法。
探究一:探究二氧化碳能否与水反应
【设计与实验】同学们取石蕊溶液染成紫色的干燥纸条,完成如下实验操作。
【解释与结论】
(1)对比实验Ⅰ、Ⅱ、Ⅲ,得出二氧化碳能与水反应,则实验Ⅱ中的现象是______ 。
(2)实验Ⅲ中使紫色纸条变红色的物质是______ (填化学式)。
(3)对比实验Ⅲ和Ⅳ,说明二氧化碳与水反应的产物和醋酸的化学性质有______ (填“不同”或“相同”)之处。
探究二:探究物质燃烧的条件
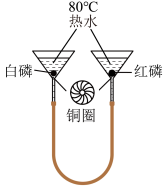
【查阅资料】白磷的着火点为40℃,红磷的着火点为240℃。
【进行实验】按如图组装装置(夹持仪器已略去)。
【现象与分析】
(4)步骤Ⅱ中的实验现象是红磷______ ,步骤Ⅲ中的操作为______ 。
(5)实验Ⅰ中白磷不燃烧,Ⅲ中白磷燃烧,对比可得物质燃烧的条件之一是______ 。
探究三:铁在不同情况下与氧气反应的实验
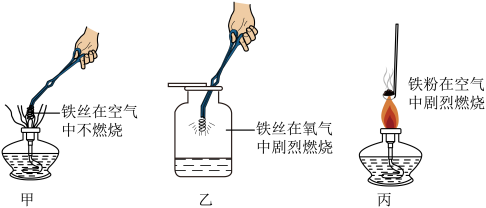
【讨论交流】
(6)对比实验______ ,说明反应物与氧气的接触面积不同,现象不同。
(7)实验乙中铁丝燃烧的化学方程式为______ ,实验现象为剧烈燃烧,______ ,放出大量热。
(8)从燃烧条件分析,实验乙在铁丝上绑一根火柴的作用是______ 。
探究一:探究二氧化碳能否与水反应
【设计与实验】同学们取石蕊溶液染成紫色的干燥纸条,完成如下实验操作。
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | 实验Ⅳ | |
| 实验操作 | 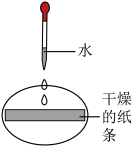 | 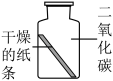 | 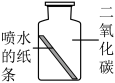 | 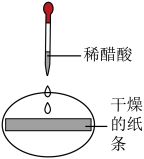 |
| 实验现象 | 紫色纸条不变色 | ______ | 紫色纸条变红色 | 紫色纸条变红色 |
(1)对比实验Ⅰ、Ⅱ、Ⅲ,得出二氧化碳能与水反应,则实验Ⅱ中的现象是
(2)实验Ⅲ中使紫色纸条变红色的物质是
(3)对比实验Ⅲ和Ⅳ,说明二氧化碳与水反应的产物和醋酸的化学性质有
探究二:探究物质燃烧的条件
【查阅资料】白磷的着火点为40℃,红磷的着火点为240℃。
【进行实验】按如图组装装置(夹持仪器已略去)。

| 实验步骤及操作 | 实验现象 |
| I、将一定量的白磷、红磷分别浸入80℃热水中 | 白磷、红磷均不燃烧 |
| Ⅱ、升高右侧漏斗至红磷露出水面 | ______ |
| Ⅲ、______ | 白磷燃烧 |
(4)步骤Ⅱ中的实验现象是红磷
(5)实验Ⅰ中白磷不燃烧,Ⅲ中白磷燃烧,对比可得物质燃烧的条件之一是
探究三:铁在不同情况下与氧气反应的实验

【讨论交流】
(6)对比实验
(7)实验乙中铁丝燃烧的化学方程式为
(8)从燃烧条件分析,实验乙在铁丝上绑一根火柴的作用是
您最近一年使用:0次



