氨碱法制纯碱的两个主要反应的化学方程式有________ 和_____
更新时间:2019-05-22 15:43:39
|
相似题推荐
【推荐1】海洋是巨大的资源宝库,人类应合理开发利用并予以保护。
(1)海水淡化。蒸馏法淡化海水是利用海水中各成分________ 不同进行分离的。
(2)海水晒盐。晒盐时,采用结晶的方法是_____ ;海水晒盐后得到的卤水是氯化钠的_____ (填“饱和”或“不饱和”)溶液。
(3)海水制镁。从海水中提取单质镁的工艺流程如下图所示:

①用卤水制镁的过程中发生中和反应的化学方程式是______ 。
②海水或卤水中本来就含有氯化镁,还需要过程①②的原因是______ 。
(4)海水制“碱”。下图为部分工业制碱的工艺流程,请结合图示回答。

①由氯化钠制取纯碱,从元素守恒的角度分析,还需要含有_____ 元素的物质参加反应;从酸碱反应的角度分析:先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳的原因为____ 。
②在盐水(含MgCl2、CaCl2杂质)精制过程中,先后加入过量的NaOH溶液和Na2CO3溶液产生的沉淀是____ 。
③写出碳酸氢钠受热分解的反应方程式_______ 。
(1)海水淡化。蒸馏法淡化海水是利用海水中各成分
(2)海水晒盐。晒盐时,采用结晶的方法是
(3)海水制镁。从海水中提取单质镁的工艺流程如下图所示:

①用卤水制镁的过程中发生中和反应的化学方程式是
②海水或卤水中本来就含有氯化镁,还需要过程①②的原因是
(4)海水制“碱”。下图为部分工业制碱的工艺流程,请结合图示回答。

①由氯化钠制取纯碱,从元素守恒的角度分析,还需要含有
②在盐水(含MgCl2、CaCl2杂质)精制过程中,先后加入过量的NaOH溶液和Na2CO3溶液产生的沉淀是
③写出碳酸氢钠受热分解的反应方程式
您最近一年使用:0次
填空与简答-流程题
|
适中
(0.65)
【推荐2】A、金属钛(Ti)的合金具有耐高温、耐腐蚀、强度高等性能,钛合金广泛用于航空、航天工业及化学工业。工业上以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,同时得到重要的化工原料甲醇(CH3OH)。生产的工艺流程图如图1所示(部分产物略去):
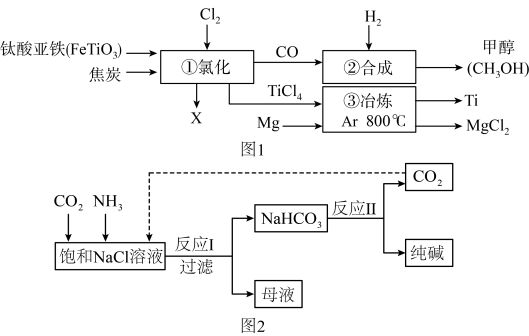
(1)该流程图中涉及到的物质属于有机物的是__ 。
(2)钛酸亚铁(FeTiO3)中钛元素的化合价为__ 。
(3)①中反应为:2FeTiO3+6C+7Cl2 2X+2TiCl4+6CO,则X的化学式为
2X+2TiCl4+6CO,则X的化学式为 __ 。
(4)③所属的基本反应类型为__ 。
(5)②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为__ 。
B、现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图2所示:已知:①NaHCO3在低温下溶解度较小,反应I为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,
NaHCO3↓+NH4Cl,
②处理母液的方法:向母液中加入石灰乳(熟石灰),其反应为:Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O
(1)纯碱的化学式为__ 。
(2)母液中一定含有的溶质是__ 。
(3)整个流程中可以循环利用的物质是__ 。

(1)该流程图中涉及到的物质属于有机物的是
(2)钛酸亚铁(FeTiO3)中钛元素的化合价为
(3)①中反应为:2FeTiO3+6C+7Cl2
 2X+2TiCl4+6CO,则X的化学式为
2X+2TiCl4+6CO,则X的化学式为 (4)③所属的基本反应类型为
(5)②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为
B、现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图2所示:已知:①NaHCO3在低温下溶解度较小,反应I为:NaCl+CO2+NH3+H2O
 NaHCO3↓+NH4Cl,
NaHCO3↓+NH4Cl,②处理母液的方法:向母液中加入石灰乳(熟石灰),其反应为:Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O
(1)纯碱的化学式为
(2)母液中一定含有的溶质是
(3)整个流程中可以循环利用的物质是
您最近一年使用:0次
【推荐3】海水可用于制造纯碱。
(1)工业上采用氨碱法生产纯碱(Na2CO3),主要流程如下图1:
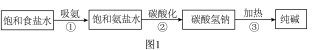
在①〜③三个过程中,发生分解反应的是______ (填序号),氨盐水比食盐水更容易吸收二氧化碳的原因是_________________ 。
(2)我国化学家侯德榜在氨碱法的基础上创立的侯氏制碱法,是向滤出NaHCO3晶体后的NH4Cl溶液中加入NaCl粉末,析出可用作肥料的NH4Cl。NH4Cl和NaCl的溶解度曲线如图2所示:
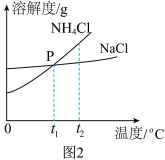
①写出一条P点表示的意义____________ 。
②将t2℃时NH4Cl饱和溶液的温度降到t1℃,溶液中NH4Cl的质量分数会_____ (填“变大”“变小”“不变”之一)。当NH4Cl固体中含有少量NaCl时,可采用____ (填“蒸发结晶”或“降温结晶”)的方法提纯NH4Cl。
③将接近饱和NaCl溶液变为饱和溶液,可采用的方法有_____________ 、_____________ 。
(1)工业上采用氨碱法生产纯碱(Na2CO3),主要流程如下图1:

在①〜③三个过程中,发生分解反应的是
(2)我国化学家侯德榜在氨碱法的基础上创立的侯氏制碱法,是向滤出NaHCO3晶体后的NH4Cl溶液中加入NaCl粉末,析出可用作肥料的NH4Cl。NH4Cl和NaCl的溶解度曲线如图2所示:

①写出一条P点表示的意义
②将t2℃时NH4Cl饱和溶液的温度降到t1℃,溶液中NH4Cl的质量分数会
③将接近饱和NaCl溶液变为饱和溶液,可采用的方法有
您最近一年使用:0次



