1 . 某兴趣小组在完成镁与稀盐酸反应的实验时,观察到有灰白色沉淀生成的“异常”现象,他们对此进行了以下探究。
【猜想假设】猜想1:Mg猜想2:MgCl2
【交流讨论】
(1)小张认为沉淀还可能是MgCO3,小王认为这一猜想是错误的,理由是______ 。
【实验I】
(2)为验证猜想2是否正确,同学们取1g样品并加入足量蒸馏水振荡,沉淀未溶解。同学们又取_______ 于试管中,也加足量蒸馏水振荡,固体全部溶解,证实猜想2错误。
【深入探究】该沉淀的物质组成
【查阅资料】灰白色沉淀的成分为碱式氯化镁。它存在多种组成,化学式可表示为Mgx(OH)yClz·nH2O;它受热分解可产生氧化镁、氯化氢和水。
【实验Ⅱ】
(3)为确定分解后的产物,同学们分别取样于试管中加热,将产物通过硫酸铜固体,看到______ ,证明有水产生,将产物通入______ 中,看到溶液呈红色,证明有氯化氢产生。
【实验III】
洗去沉淀表面杂质并室温晾干。取其7.07g,用如图装置(夹持仪器未画出)按照正确的操作步骤进行实验。待反应停止后,测得硬质玻璃管中剩余固体质量为4.00g,装置B的质量增加了2.34g。
(4)按图连接好装置,实验前要先_______ 。
(5)反应停止后,应继续通入N2一段时间,目的是______ ;该沉淀中,镁、氯的离子个数比n(Mg2+):n(Cl-)=______ 。
(6)若该沉淀Mgx(OH)yClz•nH2O中,n=5,则x、y、z的数值为_______ 。
【反思与评价】
(7)装置B、C顺序是否可以调换?请判断并叙述理由______ 。
(8)若无装置D,则测得的y数值会_______ (填偏大、偏小、不变)。
【猜想假设】猜想1:Mg猜想2:MgCl2
【交流讨论】
(1)小张认为沉淀还可能是MgCO3,小王认为这一猜想是错误的,理由是
【实验I】
(2)为验证猜想2是否正确,同学们取1g样品并加入足量蒸馏水振荡,沉淀未溶解。同学们又取
【深入探究】该沉淀的物质组成
【查阅资料】灰白色沉淀的成分为碱式氯化镁。它存在多种组成,化学式可表示为Mgx(OH)yClz·nH2O;它受热分解可产生氧化镁、氯化氢和水。
【实验Ⅱ】
(3)为确定分解后的产物,同学们分别取样于试管中加热,将产物通过硫酸铜固体,看到
【实验III】
洗去沉淀表面杂质并室温晾干。取其7.07g,用如图装置(夹持仪器未画出)按照正确的操作步骤进行实验。待反应停止后,测得硬质玻璃管中剩余固体质量为4.00g,装置B的质量增加了2.34g。
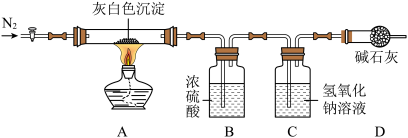
(4)按图连接好装置,实验前要先
(5)反应停止后,应继续通入N2一段时间,目的是
(6)若该沉淀Mgx(OH)yClz•nH2O中,n=5,则x、y、z的数值为
【反思与评价】
(7)装置B、C顺序是否可以调换?请判断并叙述理由
(8)若无装置D,则测得的y数值会
您最近一年使用:0次
2024·江苏泰州·一模
解题方法
2 . 牙膏是人们生活中不可缺少的必需品,某化学小组对牙膏展开探究。
某品牌牙膏主要成分:水、水合硅石、碳酸氢钠、香精、焦磷酸四钠、珍珠粉(含蛋白质、碳酸钙、多种微量元素)等。
【摩擦剂】牙膏中摩擦剂的作用是通过摩擦去除食物残渣、牙渍、牙菌斑等。常用摩擦剂有水合硅石、碳酸钙等。
(1)根据以上信息推测水合硅石可能的物理性质有________ (写1条)。
【酸碱度调节剂】研究表明,口腔中pH在6.6~7.1有利于维持口腔生态平衡,若pH过低易导致牙齿持续脱矿引发龋齿等疾病,在牙膏中添加 等物质可调节口腔酸碱度。
等物质可调节口腔酸碱度。 的质量分数。结合图中数据,计算牙膏样品中
的质量分数。结合图中数据,计算牙膏样品中 的质量分数(写出计算过程)
的质量分数(写出计算过程)________ 。
(3)用该方法测得的 质量分数偏大的原因可能是
质量分数偏大的原因可能是_______ 。(填一点)
【美白剂】牙膏中添加过氧化钙( )可除去吸附在牙齿微孔中的有色物质,美白牙齿。
)可除去吸附在牙齿微孔中的有色物质,美白牙齿。
资料:①氨气极易溶于水;②
I. 的制备:实验室可用如图装置制备
的制备:实验室可用如图装置制备 。
。
向 溶液中加入
溶液中加入 的
的 溶液,通入氨气,反应生成
溶液,通入氨气,反应生成 晶体,脱水后得到
晶体,脱水后得到 固体。反应原理:
固体。反应原理: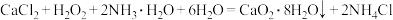
________ ,长颈漏斗的作用________ 。
(5)甲中发生反应的化学方程式为________ 。
(6)乙中反应时常用冰水浴控制温度在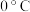 左右,目的可能是
左右,目的可能是________ 。
(7)反应结束后,经过滤、洗涤、低温烘干可获得 。检验
。检验 是否洗涤干净的方法是:取最后一次洗涤滤液,
是否洗涤干净的方法是:取最后一次洗涤滤液,________ 。
II. 的变质:
的变质:
提出猜想:久置 样品的成分可能为
样品的成分可能为 、
、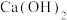 、
、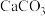 中的一种或多种。
中的一种或多种。
实验验证:小组的同学利用数字化传感器探究样品的成分。取少量样品于试管中,加入一定量的稀盐酸,测得体系中溶解氧、pH及 体积分数的数据如图。
体积分数的数据如图。 、
、 、
、 。小静同学认为该结论不正确,请结合图中数据分析,结论不正确的原因是
。小静同学认为该结论不正确,请结合图中数据分析,结论不正确的原因是________ 。
(9)由于 易变质影响牙膏的保质期,不慎吞服后,会对口腔黏膜、食道等造成伤害,因此现在牙膏中常加入二氧化钛、焦磷酸盐等其他美白成分。分析本题中介绍的牙膏成分,其中具有美白作用的物质可能是
易变质影响牙膏的保质期,不慎吞服后,会对口腔黏膜、食道等造成伤害,因此现在牙膏中常加入二氧化钛、焦磷酸盐等其他美白成分。分析本题中介绍的牙膏成分,其中具有美白作用的物质可能是________ 。
某品牌牙膏主要成分:水、水合硅石、碳酸氢钠、香精、焦磷酸四钠、珍珠粉(含蛋白质、碳酸钙、多种微量元素)等。
【摩擦剂】牙膏中摩擦剂的作用是通过摩擦去除食物残渣、牙渍、牙菌斑等。常用摩擦剂有水合硅石、碳酸钙等。
(1)根据以上信息推测水合硅石可能的物理性质有
【酸碱度调节剂】研究表明,口腔中pH在6.6~7.1有利于维持口腔生态平衡,若pH过低易导致牙齿持续脱矿引发龋齿等疾病,在牙膏中添加
 等物质可调节口腔酸碱度。
等物质可调节口腔酸碱度。
 的质量分数。结合图中数据,计算牙膏样品中
的质量分数。结合图中数据,计算牙膏样品中 的质量分数(写出计算过程)
的质量分数(写出计算过程)(3)用该方法测得的
 质量分数偏大的原因可能是
质量分数偏大的原因可能是【美白剂】牙膏中添加过氧化钙(
 )可除去吸附在牙齿微孔中的有色物质,美白牙齿。
)可除去吸附在牙齿微孔中的有色物质,美白牙齿。资料:①氨气极易溶于水;②

I.
 的制备:实验室可用如图装置制备
的制备:实验室可用如图装置制备 。
。向
 溶液中加入
溶液中加入 的
的 溶液,通入氨气,反应生成
溶液,通入氨气,反应生成 晶体,脱水后得到
晶体,脱水后得到 固体。反应原理:
固体。反应原理: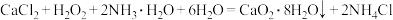

(5)甲中发生反应的化学方程式为
(6)乙中反应时常用冰水浴控制温度在
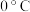 左右,目的可能是
左右,目的可能是(7)反应结束后,经过滤、洗涤、低温烘干可获得
 。检验
。检验 是否洗涤干净的方法是:取最后一次洗涤滤液,
是否洗涤干净的方法是:取最后一次洗涤滤液,II.
 的变质:
的变质:提出猜想:久置
 样品的成分可能为
样品的成分可能为 、
、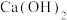 、
、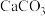 中的一种或多种。
中的一种或多种。实验验证:小组的同学利用数字化传感器探究样品的成分。取少量样品于试管中,加入一定量的稀盐酸,测得体系中溶解氧、pH及
 体积分数的数据如图。
体积分数的数据如图。
 、
、 、
、 。小静同学认为该结论不正确,请结合图中数据分析,结论不正确的原因是
。小静同学认为该结论不正确,请结合图中数据分析,结论不正确的原因是(9)由于
 易变质影响牙膏的保质期,不慎吞服后,会对口腔黏膜、食道等造成伤害,因此现在牙膏中常加入二氧化钛、焦磷酸盐等其他美白成分。分析本题中介绍的牙膏成分,其中具有美白作用的物质可能是
易变质影响牙膏的保质期,不慎吞服后,会对口腔黏膜、食道等造成伤害,因此现在牙膏中常加入二氧化钛、焦磷酸盐等其他美白成分。分析本题中介绍的牙膏成分,其中具有美白作用的物质可能是
您最近一年使用:0次
3 . 金属铁及其化合物在生产和生活中的应用极为广泛。
Ⅰ.铁及其化合物的性质
(1)生活中常用铁制成铁锅烹饪食物,主要是利用了铁的延展性和___________ 性。
(2)铁的化合物在许多领域发挥着重要作用,其中碳酸亚铁可作补血剂,写出碳酸亚铁的化学式并标出碳元素的化合价___________ 。
(3)用砂纸打磨干净的铁钉浸入硫酸铜溶液中,发生反应的化学方程式为___________ ,观察到实验现象是___________ 。
Ⅱ.铁的冶炼
(4)炼铁的主要原料是赤铁矿、焦炭、空气、石灰石,其主要转化流程如图所示。___________ ,③___________ 。
III.测定某铁粉的组成
该铁粉中含有Fe和少量的FexCy,某研究小组同学在老师的指导下进行以下实验。
【资料】①Fe,FexCy在加热时与O2反应能生成相应氧化物。
②FexCy不与酸反应。
③碱石灰的主要成分是氧化钙与氢氧化钠的固体混合物。
【实验1】取14.76 g样品,加入足量稀H2SO4,充分反应后生成0.5 gH2。
【实验2】另取14.76 g样品,按如图所示进行实验。通入足量的O2充分反应。实验后A中固体全部变为红棕色,装置B的质量增加了0.22 g。___________ 。
(6)FexCy中,x∶y =___________ (填最简整数比)。
Ⅳ.铁的锈蚀
(7)连接实验装置如图1所示,分别在瓶①、瓶②中加入对应药品,利用氧气传感器采集数据,得到图像如图2所示,同时观察,发现瓶①中铁粉没有生锈,瓶②中铁粉已生锈。___________ 。
Ⅰ.铁及其化合物的性质
(1)生活中常用铁制成铁锅烹饪食物,主要是利用了铁的延展性和
(2)铁的化合物在许多领域发挥着重要作用,其中碳酸亚铁可作补血剂,写出碳酸亚铁的化学式并标出碳元素的化合价
(3)用砂纸打磨干净的铁钉浸入硫酸铜溶液中,发生反应的化学方程式为
Ⅱ.铁的冶炼
(4)炼铁的主要原料是赤铁矿、焦炭、空气、石灰石,其主要转化流程如图所示。

III.测定某铁粉的组成
该铁粉中含有Fe和少量的FexCy,某研究小组同学在老师的指导下进行以下实验。
【资料】①Fe,FexCy在加热时与O2反应能生成相应氧化物。
②FexCy不与酸反应。
③碱石灰的主要成分是氧化钙与氢氧化钠的固体混合物。
【实验1】取14.76 g样品,加入足量稀H2SO4,充分反应后生成0.5 gH2。
【实验2】另取14.76 g样品,按如图所示进行实验。通入足量的O2充分反应。实验后A中固体全部变为红棕色,装置B的质量增加了0.22 g。

(6)FexCy中,x∶y =
Ⅳ.铁的锈蚀
(7)连接实验装置如图1所示,分别在瓶①、瓶②中加入对应药品,利用氧气传感器采集数据,得到图像如图2所示,同时观察,发现瓶①中铁粉没有生锈,瓶②中铁粉已生锈。

您最近一年使用:0次
解题方法
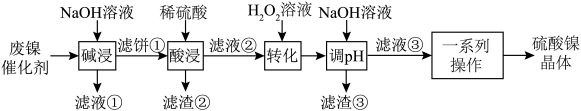
4 . 某废镍催化剂主要含金属Ni,还有少量的金属Al、Fe及其氧化物,少量的不溶性杂质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO4•7H2O):
②H2O2可将FeSO4转化为Fe2(SO4)3。
③金属Ni的活泼性与铁相近。
回答下列问题:
(1)“酸浸”前将滤饼粉碎的目的是_______ 。
(2)“酸浸”步骤中发生的主要化学反应是_______ 。
(3)滤渣③的主要成分是______ (填化学式)。
(4)请用方程式表示“转化”过程中温度不能太高的原因______ 。
(5)“一系列操作”指的是______ 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是_______ 。
②H2O2可将FeSO4转化为Fe2(SO4)3。
③金属Ni的活泼性与铁相近。
回答下列问题:
(1)“酸浸”前将滤饼粉碎的目的是
(2)“酸浸”步骤中发生的主要化学反应是
(3)滤渣③的主要成分是
(4)请用方程式表示“转化”过程中温度不能太高的原因
(5)“一系列操作”指的是
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
您最近一年使用:0次
真题
解题方法
5 . 某化学兴趣小组探究酸、碱、盐的性质,并利用其性质进行碳中和的探究学习。
【查阅资料】地球上的生命形式都以碳为基础。当今人们大量使用化石燃料,使大气中CO2的含量增加,导致温室效应加剧。减少CO2的排放,实现碳中和,已成为全球共识。碳封存、碳捕集、碳替代、碳循环是实现碳中和的主要途径。
探究一:碳封存。将CO2注入油气层起到驱油作用,既提高油的采收率,又实现碳封存。
(1)用图1装置模拟油气田封存CO2。连接装置A、B,将CO2从_______ (选填“a”或“b”)导管口通入装有油的广口瓶中封存,油被压入烧杯中。
【设计与实验】甲同学设计如图2装置(夹持仪器已省略),检查装置气密性,装入药品如图所示,关闭K1、K2、K3。
【实验结论】CO2能与NaOH反应。
【交流与讨论】
(2)乙同学认为甲同学得出结论的证据不足,理由是_______ 。
(3)在甲同学实验后,乙同学取C中物质进行了补充实验,经分析判断,证明了CO2能与NaOH反应。则乙同学的方案是_______ (写出实验操作和现象)。
(4)用NaOH溶液“捕集CO2”的化学方程式为________ 。
【实验拓展】
(5)打开K3,观察到E中稀盐酸进入D中,溶液变为无色。
①D中发生反应的化学方程式为________ 。
②为确定E中稀盐酸进入D中反应后溶液中溶质的成分(酚酞除外),下列药品可选用的有_______ (填序号)。
A.石蕊溶液 B.CuSO4溶液 C.AgNO3溶液 D.Fe2O3固体
(6)通过探究二,可归纳出碱的化学性质有_______ 。
探究三:碳循环。利用CO2与H2反应,产生有应用价值的液体有机化合物,属于碳中和技术。
(7)利用CO2与H2在一定条件下反应生成甲醇(CH3OH)和水,反应的化学方程式为_______ 。
【查阅资料】地球上的生命形式都以碳为基础。当今人们大量使用化石燃料,使大气中CO2的含量增加,导致温室效应加剧。减少CO2的排放,实现碳中和,已成为全球共识。碳封存、碳捕集、碳替代、碳循环是实现碳中和的主要途径。
探究一:碳封存。将CO2注入油气层起到驱油作用,既提高油的采收率,又实现碳封存。
(1)用图1装置模拟油气田封存CO2。连接装置A、B,将CO2从

【设计与实验】甲同学设计如图2装置(夹持仪器已省略),检查装置气密性,装入药品如图所示,关闭K1、K2、K3。

【实验结论】CO2能与NaOH反应。
【交流与讨论】
(2)乙同学认为甲同学得出结论的证据不足,理由是
(3)在甲同学实验后,乙同学取C中物质进行了补充实验,经分析判断,证明了CO2能与NaOH反应。则乙同学的方案是
(4)用NaOH溶液“捕集CO2”的化学方程式为
【实验拓展】
(5)打开K3,观察到E中稀盐酸进入D中,溶液变为无色。
①D中发生反应的化学方程式为
②为确定E中稀盐酸进入D中反应后溶液中溶质的成分(酚酞除外),下列药品可选用的有
A.石蕊溶液 B.CuSO4溶液 C.AgNO3溶液 D.Fe2O3固体
(6)通过探究二,可归纳出碱的化学性质有
探究三:碳循环。利用CO2与H2反应,产生有应用价值的液体有机化合物,属于碳中和技术。
(7)利用CO2与H2在一定条件下反应生成甲醇(CH3OH)和水,反应的化学方程式为
您最近一年使用:0次
2024-04-27更新
|
805次组卷
|
5卷引用:题型突破07 实验探究题-备战2024年中考化学复习题型突破学·练·考(全国通用)
(已下线)题型突破07 实验探究题-备战2024年中考化学复习题型突破学·练·考(全国通用)(已下线)专题12??实验探究题-2024年中考化学二轮热点题型归纳与变式演练(全国通用)(已下线)专题12 科学探究题-2024年中考化学二轮热点题型归纳与变式演练(广东通用)2023年贵州省中考理科综合真题-初中化学2024中考一轮复习考点微专题-专题09酸碱中和反应与pH-考点专练
2024九年级·全国·专题练习
6 . 学习小组开展了“基于特定需求设计和制作简易供氧器”的实践活动。
【活动一】探究反应原理
某款家用制氧机利用过碳酸钠(化学式为2Na2CO3·3H2O2)和二氧化锰同时加入水中制取氧气。
资料:①过碳酸钠易溶于水,遇水分解为Na2CO3和H2O2,能产生氧气并放出热量。②高浓度过氧化氢腐蚀性强。
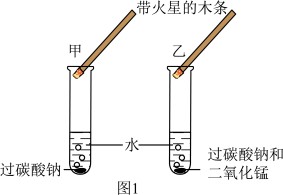
(1)小组同学用图1所示实验装置探究是否有氧气生成。观察到甲试管中有小气泡缓慢冒出,木条不复燃;乙试管中小气泡快速冒出,木条复燃。___________ 。
②写出乙试管中过氧化氢生成氧气的化学方程式:___________ 。
【活动二】认识制氯机
(2)图2为制氧机的内部结构图,其中加湿仓的作用是___________ 。下列相关说法正确的是___________ (填字母)。
B.加湿仓利用了氧气不易溶于水的物理性质
【活动三】选择制氧剂分
实验一:过氧化氢
小组同学设计了图3实验装置,用表1中溶质质量相等的四组过氧化氢溶液进行实验。在集气瓶中加满水,锥形瓶中加入0.2gMnO2,注入溶液,记录并处理20min内数据如图4。
表1
___________ 。
(4)根据资料分析,④比③产氧量少,可能的原因是___________ 。
(5)从安全角度考虑,应选择浓度为___________ 的过氧化氢溶液作为制氧剂。
实验二:过碳酸钠
往锥形瓶中加入ag过碳酸钠、0.2gMnO2和9.11mL水,待反应完全后收集到约159.1mL水(产生氧气的量与表1中药品得到氧气的最大量相等)。其他药品质量不变,再分别用不同体积的水进行实验。记录并处理20min内数据如图5。___________ g。(氧气密度为1.43g/L,忽略其他因素的影响,计算结果精确到0.1)
(7)由图5可得出的结论是___________ 。
【活动一】探究反应原理
某款家用制氧机利用过碳酸钠(化学式为2Na2CO3·3H2O2)和二氧化锰同时加入水中制取氧气。
资料:①过碳酸钠易溶于水,遇水分解为Na2CO3和H2O2,能产生氧气并放出热量。②高浓度过氧化氢腐蚀性强。
(1)小组同学用图1所示实验装置探究是否有氧气生成。观察到甲试管中有小气泡缓慢冒出,木条不复燃;乙试管中小气泡快速冒出,木条复燃。
②写出乙试管中过氧化氢生成氧气的化学方程式:
【活动二】认识制氯机
(2)图2为制氧机的内部结构图,其中加湿仓的作用是

B.加湿仓利用了氧气不易溶于水的物理性质
【活动三】选择制氧剂分
实验一:过氧化氢
小组同学设计了图3实验装置,用表1中溶质质量相等的四组过氧化氢溶液进行实验。在集气瓶中加满水,锥形瓶中加入0.2gMnO2,注入溶液,记录并处理20min内数据如图4。
表1
| 编号 | 浓度/% | 体积/mL |
| ① | 5 | 9.11 |
| ② | 15 | 2.89 |
| ③ | 25 | 1.66 |
| ④ | 30 | 1.37 |

(4)根据资料分析,④比③产氧量少,可能的原因是
(5)从安全角度考虑,应选择浓度为
实验二:过碳酸钠
往锥形瓶中加入ag过碳酸钠、0.2gMnO2和9.11mL水,待反应完全后收集到约159.1mL水(产生氧气的量与表1中药品得到氧气的最大量相等)。其他药品质量不变,再分别用不同体积的水进行实验。记录并处理20min内数据如图5。

(7)由图5可得出的结论是
您最近一年使用:0次
2024九年级·全国·专题练习
7 . 实验室中有两瓶没有贴标签的白色固体,已知是氯化钠固体和氢氧化钠固体中的各一种,小明和小红为确定各是哪种物质,进行了实验探究。
已知某固体混合物A中可能含有Na2CO3、Ba(NO3)2、NH4Cl、(NH4)2SO4四种物质中的两种或多种。小明和小红共同探究A的成分,他们分别取一定量固体混合物A,按如图所示进行探究实验,出现的现象如图中所述。(设过程中所有发生的反应都恰好完全反应 )
(1)无色气体E为_______ (填化学式);白色沉淀F为_______ (填化学式)。
(2)写出步骤I中发生反应的一个化学方程式:_______ 。
(3)在无色滤液G中,一定大量存在的阳离子是_______ (填离子符号)。
(4)根据上述实验现象推断,在固体混合物A中,(NH4)2SO4_______ (选填“一定存在”“一定不存在”“无法确定”之一),得出此结论的理由是_______ 。
已知某固体混合物A中可能含有Na2CO3、Ba(NO3)2、NH4Cl、(NH4)2SO4四种物质中的两种或多种。小明和小红共同探究A的成分,他们分别取一定量固体混合物A,按如图所示进行探究实验,出现的现象如图中所述。(

(1)无色气体E为
(2)写出步骤I中发生反应的一个化学方程式:
(3)在无色滤液G中,一定大量存在的阳离子是
(4)根据上述实验现象推断,在固体混合物A中,(NH4)2SO4
您最近一年使用:0次
8 . 氯化钠是重要的调味品。
(1)我国劳动人民早在1837年开始尝试取井水煮卤,获得的氯化钠中仍含有氯化镁等杂质,古人采用“淋盐沥水”(用饱和氯化钠溶液洗涤粗盐)的方法除去氯化镁,是因为_______ 。
兴趣小组同学想利用所学知识从粗盐中提纯氯化钠固体。查阅资料获知,粗盐除去泥沙后还含有少量CaCl2、MgCl2、Na2SO4等可溶性杂质。
【试剂选择】
(2)大家一致认为,除杂所选择的试剂一定要满足以下条件:只能与杂质反应、______ 、且易分离。经讨论选用的试剂是NaOH溶液、Na2CO3溶液和BaCl2溶液。
【实验探究】_____ 种,请写出其中一种________ 。
(4)滤液中含有的溶质是_______ 。
(5)本实验蒸发是为了除去________ (填化学式)。
(6)小组同学经过认真思考,认为可以用过量的____ 溶液(填一种物质)代替NaOH和BaCl2两种溶液,也能达到实验目的。
(1)我国劳动人民早在1837年开始尝试取井水煮卤,获得的氯化钠中仍含有氯化镁等杂质,古人采用“淋盐沥水”(用饱和氯化钠溶液洗涤粗盐)的方法除去氯化镁,是因为
兴趣小组同学想利用所学知识从粗盐中提纯氯化钠固体。查阅资料获知,粗盐除去泥沙后还含有少量CaCl2、MgCl2、Na2SO4等可溶性杂质。
【试剂选择】
(2)大家一致认为,除杂所选择的试剂一定要满足以下条件:只能与杂质反应、
【实验探究】

(4)滤液中含有的溶质是
(5)本实验蒸发是为了除去
(6)小组同学经过认真思考,认为可以用过量的
您最近一年使用:0次
9 . 某学习小组用大理石和稀盐酸制取氧化碳,并进行相关性质实验。
①写出制备二氧化碳的化学反应方程式_______ 。
②收集干燥 时先通过装置C,气流方向为
时先通过装置C,气流方向为_______ (填“ 进
进 出”或“
出”或“ 进
进 出”),再选取收集装置
出”),再选取收集装置_______ (选填字母)。
③装置 为启普发生器,表示正在产生气体的是装置
为启普发生器,表示正在产生气体的是装置_______ (填 或
或 )。
)。
(2)探究 水溶液的性质
水溶液的性质
已知:在常温、气体压强为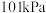 时,1体积水里最多能溶解大约1体积
时,1体积水里最多能溶解大约1体积 。
。
①常温下向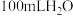 中缓慢通入
中缓慢通入 至饱和,用
至饱和,用 计测定饱和溶液
计测定饱和溶液 ,静置
,静置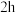 后,再次读取溶液
后,再次读取溶液 ,结果如表所示。
,结果如表所示。
使用 试纸测定溶液
试纸测定溶液 时,玻璃棒的作用是
时,玻璃棒的作用是_______ (填字母)。
A.引流 .蘸取溶液
.蘸取溶液  .搅拌
.搅拌
②静置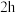 后,
后, 水溶液酸性
水溶液酸性_______ (填“增强”或“减弱”),发生变化的原因可能是_______ 。
③有同学根据溶液的 认为
认为 也是造成酸雨的重要因素。请判断该推论是否正确,并说明理由:
也是造成酸雨的重要因素。请判断该推论是否正确,并说明理由:_______ 。
(3)探究不同液体对 的吸收效果
的吸收效果
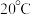 时,该组同学用图2装置探究水、饱和石灰水(溶质的质量分数为
时,该组同学用图2装置探究水、饱和石灰水(溶质的质量分数为 )、
)、 的氢氧化钠稀溶液,
的氢氧化钠稀溶液,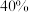 的氢氧化钠浓溶液对
的氢氧化钠浓溶液对 的吸收情况。在4个各盛有
的吸收情况。在4个各盛有 气体的烧瓶上连接压强传感器,待瓶内气压平稳后分别迅速注入
气体的烧瓶上连接压强传感器,待瓶内气压平稳后分别迅速注入 上述四种不同液体,记录压强随时间变化的曲线如图3所示。(稀溶液的密度近似为
上述四种不同液体,记录压强随时间变化的曲线如图3所示。(稀溶液的密度近似为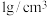 )
) .
. 过量时,
过量时,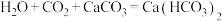 ,
,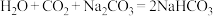 。
。
 .
.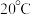 时,碳酸钙的溶解度约为
时,碳酸钙的溶解度约为 ,碳酸氢钙的溶解度约为
,碳酸氢钙的溶解度约为 。
。
①四种液体中吸收二氧化碳效果最好的是_______ 。
②饱和石灰水吸收 的实验中可能出现的现象是
的实验中可能出现的现象是_______ 。
③理论上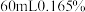 饱和石灰水可吸收的
饱和石灰水可吸收的 比
比 的氢氧化钠稀溶液可吸收的
的氢氧化钠稀溶液可吸收的 多,但实验结果恰好相反,出现该现象的原因可能是
多,但实验结果恰好相反,出现该现象的原因可能是_______ 。

①写出制备二氧化碳的化学反应方程式
②收集干燥
 时先通过装置C,气流方向为
时先通过装置C,气流方向为 进
进 出”或“
出”或“ 进
进 出”),再选取收集装置
出”),再选取收集装置③装置
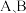 为启普发生器,表示正在产生气体的是装置
为启普发生器,表示正在产生气体的是装置 或
或 )。
)。(2)探究
 水溶液的性质
水溶液的性质已知:在常温、气体压强为
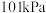 时,1体积水里最多能溶解大约1体积
时,1体积水里最多能溶解大约1体积 。
。①常温下向
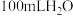 中缓慢通入
中缓慢通入 至饱和,用
至饱和,用 计测定饱和溶液
计测定饱和溶液 ,静置
,静置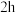 后,再次读取溶液
后,再次读取溶液 ,结果如表所示。
,结果如表所示。饱和溶液 | 静置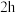 后溶液 后溶液 | |
 水溶液 水溶液 | 3.94 | 4.12 |
 试纸测定溶液
试纸测定溶液 时,玻璃棒的作用是
时,玻璃棒的作用是A.引流
 .蘸取溶液
.蘸取溶液  .搅拌
.搅拌②静置
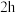 后,
后, 水溶液酸性
水溶液酸性③有同学根据溶液的
 认为
认为 也是造成酸雨的重要因素。请判断该推论是否正确,并说明理由:
也是造成酸雨的重要因素。请判断该推论是否正确,并说明理由:(3)探究不同液体对
 的吸收效果
的吸收效果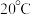 时,该组同学用图2装置探究水、饱和石灰水(溶质的质量分数为
时,该组同学用图2装置探究水、饱和石灰水(溶质的质量分数为 )、
)、 的氢氧化钠稀溶液,
的氢氧化钠稀溶液,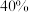 的氢氧化钠浓溶液对
的氢氧化钠浓溶液对 的吸收情况。在4个各盛有
的吸收情况。在4个各盛有 气体的烧瓶上连接压强传感器,待瓶内气压平稳后分别迅速注入
气体的烧瓶上连接压强传感器,待瓶内气压平稳后分别迅速注入 上述四种不同液体,记录压强随时间变化的曲线如图3所示。(稀溶液的密度近似为
上述四种不同液体,记录压强随时间变化的曲线如图3所示。(稀溶液的密度近似为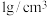 )
)
 .
. 过量时,
过量时,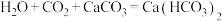 ,
,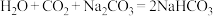 。
。 .
.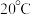 时,碳酸钙的溶解度约为
时,碳酸钙的溶解度约为 ,碳酸氢钙的溶解度约为
,碳酸氢钙的溶解度约为 。
。①四种液体中吸收二氧化碳效果最好的是
②饱和石灰水吸收
 的实验中可能出现的现象是
的实验中可能出现的现象是③理论上
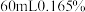 饱和石灰水可吸收的
饱和石灰水可吸收的 比
比 的氢氧化钠稀溶液可吸收的
的氢氧化钠稀溶液可吸收的 多,但实验结果恰好相反,出现该现象的原因可能是
多,但实验结果恰好相反,出现该现象的原因可能是
您最近一年使用:0次
10 . 硫酸铜可用于制造其它铜盐、染料、农药等。有关CuSO4制备途径及性质探究过程如图所示。 CuSO4+SO₂↑+2H2O回答下列问题:
CuSO4+SO₂↑+2H2O回答下列问题:
(1)途径①中80g铜与200g98%浓硫酸加热条件充分反应可得到硫酸铜_______ 160g(选填“>”“=”或“<”)。
(2)途径②与途径①相比的优点是_______ (写出一点即可)。
(3)途径③分解所得混合气体X的成分除SO3外,一定还含有_______ (写化学式)。
(4)途径④加入一定质量的40%NaOH溶液,所得沉淀的化学式为Cux(OH)4(SO4)m为测定其化学组成,取35.6g所得沉淀,加入足量盐酸使之完全溶解,再加入足量的BaCl2溶液,充分反应后过滤、洗涤、干燥,得固体23.3g。
①试确定沉淀Cux(OH)4(SO4)m的化学式_______ 。
②加入NaOH溶液的质量至少为多少?_______ (写出计算过程)。

 CuSO4+SO₂↑+2H2O回答下列问题:
CuSO4+SO₂↑+2H2O回答下列问题:(1)途径①中80g铜与200g98%浓硫酸加热条件充分反应可得到硫酸铜
(2)途径②与途径①相比的优点是
(3)途径③分解所得混合气体X的成分除SO3外,一定还含有
(4)途径④加入一定质量的40%NaOH溶液,所得沉淀的化学式为Cux(OH)4(SO4)m为测定其化学组成,取35.6g所得沉淀,加入足量盐酸使之完全溶解,再加入足量的BaCl2溶液,充分反应后过滤、洗涤、干燥,得固体23.3g。
①试确定沉淀Cux(OH)4(SO4)m的化学式
②加入NaOH溶液的质量至少为多少?
您最近一年使用:0次



