解题方法
1 . 煤是重要的能源,也是化工产品的生产原料。
(1)随着煤、石油等______ (填“可再生”或“不可再生”)能源大量消耗,开发更多的新能源显得相当重要。试列举一项新能源:______ 。
(2)乌黑的煤炭经过化学加工合成天然气的工艺流程如图所示。______ 。
②一定条件下,经“变换炉”反应后,CO含量降低,则气体含量增加的是______ 。
③合成天然气(CH4)燃烧的化学方程式是______ 。
(3)一定条件下,将上述煤气化炉制得的氢气与氮气反应生成氨气,氨气进一步氧化为NO,进而可生产硝酸。
①氮气通常用液化空气分离法获得:在压强为101kPa时,液态氮的沸点是-196℃,液态氧的沸点是-183℃,则随温度升高先逸出的气体是______ 。
②17gNH3与______ gHNO3具有相同质量的氮。
③如图是氨氧化率与氨—空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上Y【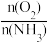 】=1.25,实际生产要将y值维护在1.7~2.2之间,原因是
】=1.25,实际生产要将y值维护在1.7~2.2之间,原因是_______ 。
(1)随着煤、石油等
(2)乌黑的煤炭经过化学加工合成天然气的工艺流程如图所示。
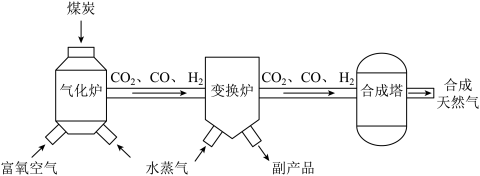
②一定条件下,经“变换炉”反应后,CO含量降低,则气体含量增加的是
③合成天然气(CH4)燃烧的化学方程式是
(3)一定条件下,将上述煤气化炉制得的氢气与氮气反应生成氨气,氨气进一步氧化为NO,进而可生产硝酸。
①氮气通常用液化空气分离法获得:在压强为101kPa时,液态氮的沸点是-196℃,液态氧的沸点是-183℃,则随温度升高先逸出的气体是
②17gNH3与
③如图是氨氧化率与氨—空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上Y【
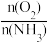 】=1.25,实际生产要将y值维护在1.7~2.2之间,原因是
】=1.25,实际生产要将y值维护在1.7~2.2之间,原因是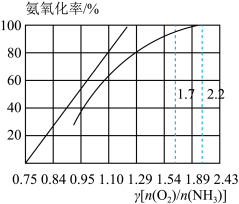
您最近一年使用:0次
2024-04-20更新
|
183次组卷
|
3卷引用:押南通卷第13题 填空题——化学与生活-备战2024年中考化学临考题号押题(南通专用)
(已下线)押南通卷第13题 填空题——化学与生活-备战2024年中考化学临考题号押题(南通专用)2024年江苏省南通市海安市九年级中考一模物理化学试题-初中化学2024年江苏省南通市海安市一模化学试题
2 . “液态阳光”是指生产过程中碳排放极低或为零时制得的甲醇(CH3OH),甲醇完全燃烧的产物与乙醇相同,请写出甲醇完全燃烧的化学方程式:_________ 。若氧气不充足,甲醇燃烧时还会生成CO。若一定量的甲醇在3.2gO2中燃烧,充分反应后得到2.7gH2O、0.7gCO和一定质量的CO2,则CO2的质量为_____ g。
您最近一年使用:0次
2024-04-17更新
|
60次组卷
|
3卷引用:押无锡卷第21-23题 非选择题-备战2024年中考化学临考题号押题(无锡专用)
解题方法
3 . 金属材料在日常生活、工业上有广泛应用。
(1)铁是生活中应用最多的金属。铁易生锈,形成Fe2O3,Fe2O3属于______ (选填“酸”“碱”“盐”或“氧化物”),Fe2O3可用盐酸除去,写出反应的化学方程式______ 。
(2)铝具有良好的延展性。“延展性”属于______ (选填“物理性质”或“化学性质”)。冶炼铝时,先将冰晶石高温熔化,再将Al2O3加入,待Al2O3溶解后进行电解,该过程冰晶石可以看作______ (选填“溶质”或“溶剂”)。
(3)孔雀石(主要含Cu2(OH)2CO3)可以冶炼铜。孔雀石中元素含量最高的是______ ;将1 mol Cu2(OH)2CO3中的铜完全冶炼出来,可以得到单质铜______ mol。
(4)人类有规模使用金属单质的顺序是铜、铁、铝,请分析上述顺序的原因是______ (写出一条)。
(1)铁是生活中应用最多的金属。铁易生锈,形成Fe2O3,Fe2O3属于
(2)铝具有良好的延展性。“延展性”属于
(3)孔雀石(主要含Cu2(OH)2CO3)可以冶炼铜。孔雀石中元素含量最高的是
(4)人类有规模使用金属单质的顺序是铜、铁、铝,请分析上述顺序的原因是
您最近一年使用:0次
名校
解题方法
4 . 青花瓷是最具代表性的中国瓷器。绘制青花瓷纹饰的原料中主要含有氧化钴。钴在元素周期表中位于第4周期、第Ⅷ族,其化学性质与铁相似。
元素周期表(部分)
(1)钴的原子序数是___________ 。
(2)钴的化合物钴酸锂(化学式LiCoO2,锂元素化合价为+1)常用作手机电池的正极材料,其中钴元素的化合价为___________ 。
(3)在化学反应中,金属钴和铁一样,也能与稀硫酸发生反应放出氢气,反应的化学方程式为___________ 。
(4)在空气中煅烧草酸亚钴(CoC2O4)生成钴的一种氧化物和CO2气体。取一定草酸亚钴充分煅烧后,测得固体质量为4.82g,生成CO2的质量为5.28g。则产物中氧化物的化学式是___________ 。
元素周期表(部分)
| ⅦB | Ⅷ | ⅠB | |||
| 4 | 25 Mn 锰 54.94 | 26 Fe 铁 55.85 | 27 Co 钴 58.93 | 28 Ni 镍 58.96 | 29 Cu 铜 63.55 |
(1)钴的原子序数是
(2)钴的化合物钴酸锂(化学式LiCoO2,锂元素化合价为+1)常用作手机电池的正极材料,其中钴元素的化合价为
(3)在化学反应中,金属钴和铁一样,也能与稀硫酸发生反应放出氢气,反应的化学方程式为
(4)在空气中煅烧草酸亚钴(CoC2O4)生成钴的一种氧化物和CO2气体。取一定草酸亚钴充分煅烧后,测得固体质量为4.82g,生成CO2的质量为5.28g。则产物中氧化物的化学式是
您最近一年使用:0次
解题方法
5 . “化学氧自救器”是一种在缺氧环境中通过化学制氧剂临时供氧的装置,制氧剂主要成分为超氧化钾( ),产生氧气的原理为:
),产生氧气的原理为: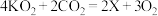 。
。
(1)超氧化钾中氧元素的质量分数为______ (精确到0.1%),X的化学式是______ 。
(2)要制得48g氧气,需要含 80%的制氧剂的质量是多少?(写出计算过程)
80%的制氧剂的质量是多少?(写出计算过程)
 ),产生氧气的原理为:
),产生氧气的原理为: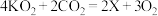 。
。(1)超氧化钾中氧元素的质量分数为
(2)要制得48g氧气,需要含
 80%的制氧剂的质量是多少?(写出计算过程)
80%的制氧剂的质量是多少?(写出计算过程)
您最近一年使用:0次
2024-04-13更新
|
63次组卷
|
3卷引用:2024年山西省太原市多校中考考前适应性训练试题理科综合试卷-初中化学
6 . 填空。
(1)按要求从氧化钙,氧气,硝酸钾,氢气,氢氧化铁中选择合适的物质将其化学式填写在下列横线中。
①一种可以燃烧的气体_______ 。
②一种难溶于水的碱_______ 。
③一种金属氧化物_______ 。
④一种常用作复合肥的盐_______ 。
(2)化学就在我们身边,人类的生活离不开化学。请回答下列问题:
①正常情况下,人体中的元素主要来自各种食物,这既有利于人体的代谢活动,也有利于维持各元素之间的相对平衡。下列食物中主要富含糖类物质的是_______ (填字母序号)。_______ (填字母序号)。
③常用的农药绝大多数都是用化学方法配制或合成的,波尔多液就是人类较早使用并且一直沿用至今的一种农用杀菌剂。配好的波尔多液不能装在铁桶内,原因是_______ (用化学方程式表示)。
④吗啡、杜冷丁等麻醉品或精神药物被非法使用,即会成为毒品。吸毒对社会、家庭和个人都有极大的危害。请牢记:珍爱生命,拒绝毒品!在吗啡 中碳、氧元素的质量比是
中碳、氧元素的质量比是_______ (填最简整数比),吗啡中质量分数最大的元素是_______ (填元素名称)。
(1)按要求从氧化钙,氧气,硝酸钾,氢气,氢氧化铁中选择合适的物质将其化学式填写在下列横线中。
①一种可以燃烧的气体
②一种难溶于水的碱
③一种金属氧化物
④一种常用作复合肥的盐
(2)化学就在我们身边,人类的生活离不开化学。请回答下列问题:
①正常情况下,人体中的元素主要来自各种食物,这既有利于人体的代谢活动,也有利于维持各元素之间的相对平衡。下列食物中主要富含糖类物质的是
A. 馒头 B.
馒头 B. 西红柿 C.
西红柿 C. 牛肉 D.
牛肉 D. 黄花鱼
黄花鱼

③常用的农药绝大多数都是用化学方法配制或合成的,波尔多液就是人类较早使用并且一直沿用至今的一种农用杀菌剂。配好的波尔多液不能装在铁桶内,原因是
④吗啡、杜冷丁等麻醉品或精神药物被非法使用,即会成为毒品。吸毒对社会、家庭和个人都有极大的危害。请牢记:珍爱生命,拒绝毒品!在吗啡
 中碳、氧元素的质量比是
中碳、氧元素的质量比是
您最近一年使用:0次
2024-04-11更新
|
233次组卷
|
4卷引用:专题04 化学与社会-【查漏补缺】2024年中考复习冲刺过关(全国通用)
(已下线)专题04 化学与社会-【查漏补缺】2024年中考复习冲刺过关(全国通用)2024年山东省济南市商河县中考一模化学试题2024年山东省济南市中考模拟考试化学试题(已下线)【临考满分卷】2024年中考化学临考满分卷(济南专用)
解题方法
7 . 我国承诺:2030年“碳达峰”,2060年“碳中和”,体现大国担当。丁仲礼院士认为“碳中和”是让人为排放的CO2,被人为努力和自然过程所吸收。
Ⅰ.碳排放
(1)查阅图,动植物呼吸_____(填“能”或“不能”)释放CO2。
(2)自然吸收:查阅图,CO2的自然吸收途径有______(填图中序号)。
(3)人为努力:CO2的捕捉是减少碳排放的有效措施。如图是实际生产中采用足量NaOH溶液来“捕捉”CO2的工艺流程:_______ 。
②“捕捉室”中NaOH溶液采用喷雾方式加入,目的是_______ ,发生反应的化学方程式为_______ 。
③“捕捉室”中的NaOH溶液与“反应器”中的X溶液可否互换?原因是_______ 。
(4)整个流程中可以循环使用的物质是_____(填化学式)。
Ⅲ.碳利用
(5)我国科学家在实验室实现以CO2和H2为原料人工合成淀粉(C6H10O5)n,若用44gCO2人工合成淀粉(假设反应过程中无含碳物质的加入和损失),理论上制得淀粉的质量为_______g。
Ⅰ.碳排放
(1)查阅图,动植物呼吸_____(填“能”或“不能”)释放CO2。
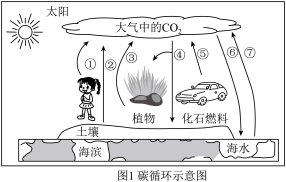
(2)自然吸收:查阅图,CO2的自然吸收途径有______(填图中序号)。
(3)人为努力:CO2的捕捉是减少碳排放的有效措施。如图是实际生产中采用足量NaOH溶液来“捕捉”CO2的工艺流程:
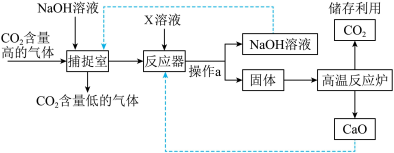
②“捕捉室”中NaOH溶液采用喷雾方式加入,目的是
③“捕捉室”中的NaOH溶液与“反应器”中的X溶液可否互换?原因是
(4)整个流程中可以循环使用的物质是_____(填化学式)。
Ⅲ.碳利用
(5)我国科学家在实验室实现以CO2和H2为原料人工合成淀粉(C6H10O5)n,若用44gCO2人工合成淀粉(假设反应过程中无含碳物质的加入和损失),理论上制得淀粉的质量为_______g。
您最近一年使用:0次
2024-04-07更新
|
257次组卷
|
6卷引用:易错类型12 工艺流程“四个”易错提醒-备战2024年中考化学考试易错题(全国通用)
(已下线)易错类型12 工艺流程“四个”易错提醒-备战2024年中考化学考试易错题(全国通用)(已下线)专题09 推断题、工业流程题、溶解度曲线题-2024年中考化学二轮热点题型归纳与变式演练(辽宁专用)(已下线)押苏州卷非选择题——流程题-备战2024年中考化学临考题号押题(苏州专用)江苏省苏州市吴江实验初中教育集团4月模拟化学试卷(已下线)信息必刷卷03(深圳专用)-2024年中考化学考前信息必刷卷(已下线)专题07 碳和碳的氧化物-【好题汇编】2024年中考化学一模试题分类汇编(江苏专用)
解题方法
8 . 下图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列化学实验。
(1)若以石灰石和稀盐酸为原料,在实验室中制备并收集纯净、干燥的二氧化碳气体,按要求设计实验装置、连接仪器,并检验装置的气密性。(提示:盐酸中挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)
①所选仪器的连接顺序为______ (从左到右填仪器序号字母)。
②上述制取二氧化碳的化学方程式为______ 。
③下列关于二氧化碳的叙述中,不正确的是______ (填选项序号之一)。
A.二氧化碳分子是由碳原子和氧分子构成的
B.通常状况下,二氧化碳不能燃烧,也不能支持燃烧
C.将二氧化碳气体通入紫色石蕊试液,溶液变红
D.固体二氧化碳俗称干冰,可用于人工降雨
(2)以过氧化氢溶液为原料(二氧化锰作催化剂)在实验室中制取氧气,并对某种塑料固体样品的组成进行分析探究实验(资料显示该塑料样品中一定只含C、H两种元素),所选仪器按“B→A1→C→A2→D→碱石灰干燥管”的顺序连接(A1、A2为浓硫酸洗气瓶),检查装置气密性,然后进行实验。使一定质量的该塑料试样碎屑在充足氧气中充分燃烧,观察现象,收集有关实验数据。(假设发生的化学反应都充分反应)
①上述连接中洗气瓶A1的作用是______ 。
②在仪器B中,发生反应的化学方程式为______ 。
③将一定质量的该塑料试样充分燃烧后,测得仪器A2质量增加7.2g,仪器D质量增加17.6g,则该塑料试样的质量为______ g(结果精确至0.1g)
(3)某化学小组的同学发现,利用这套装置还可以测定氧化铁样品(样品中含少量固体杂质,杂质不含铁且不参加反应)中氧化铁的质量分数。所选仪器按“CO(含少量水蒸气)→A→C→D→碱石灰干燥管→尾气处理装置”的顺序连接。他们的测定方法是:称量氧化铁样品的质量为11.0g,样品与玻璃管的总质量为50.0g,完全反应并冷却后,再称量玻璃管与剩余固体的总质量为47.6g。(实验前检验装置的气密性,假设所发生的化学反应都充分反应)
①写出一氧化碳与氧化铁充分反应的化学方程式:______ 。
②计算实验测得氧化铁样品中氧化铁的质量分数为______ (结果精确至0.1%)。
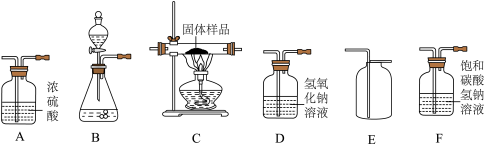
(1)若以石灰石和稀盐酸为原料,在实验室中制备并收集纯净、干燥的二氧化碳气体,按要求设计实验装置、连接仪器,并检验装置的气密性。(提示:盐酸中挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)
①所选仪器的连接顺序为
②上述制取二氧化碳的化学方程式为
③下列关于二氧化碳的叙述中,不正确的是
A.二氧化碳分子是由碳原子和氧分子构成的
B.通常状况下,二氧化碳不能燃烧,也不能支持燃烧
C.将二氧化碳气体通入紫色石蕊试液,溶液变红
D.固体二氧化碳俗称干冰,可用于人工降雨
(2)以过氧化氢溶液为原料(二氧化锰作催化剂)在实验室中制取氧气,并对某种塑料固体样品的组成进行分析探究实验(资料显示该塑料样品中一定只含C、H两种元素),所选仪器按“B→A1→C→A2→D→碱石灰干燥管”的顺序连接(A1、A2为浓硫酸洗气瓶),检查装置气密性,然后进行实验。使一定质量的该塑料试样碎屑在充足氧气中充分燃烧,观察现象,收集有关实验数据。(假设发生的化学反应都充分反应)
①上述连接中洗气瓶A1的作用是
②在仪器B中,发生反应的化学方程式为
③将一定质量的该塑料试样充分燃烧后,测得仪器A2质量增加7.2g,仪器D质量增加17.6g,则该塑料试样的质量为
(3)某化学小组的同学发现,利用这套装置还可以测定氧化铁样品(样品中含少量固体杂质,杂质不含铁且不参加反应)中氧化铁的质量分数。所选仪器按“CO(含少量水蒸气)→A→C→D→碱石灰干燥管→尾气处理装置”的顺序连接。他们的测定方法是:称量氧化铁样品的质量为11.0g,样品与玻璃管的总质量为50.0g,完全反应并冷却后,再称量玻璃管与剩余固体的总质量为47.6g。(实验前检验装置的气密性,假设所发生的化学反应都充分反应)
①写出一氧化碳与氧化铁充分反应的化学方程式:
②计算实验测得氧化铁样品中氧化铁的质量分数为
您最近一年使用:0次
2024-04-07更新
|
77次组卷
|
3卷引用:专题05 化学实验基础(测试)-2024年中考化学二轮复习讲练测(全国通用)
(已下线)专题05 化学实验基础(测试)-2024年中考化学二轮复习讲练测(全国通用)2024年山东省济南市莱芜区中考一模化学试题山东省济南市莱芜区和庄乡普通中学2023-2024学年八年级下学期5月学习成果展示化学试题
名校
9 . 二氧化锰因应用广泛而备受关注。某研究小组用废旧电池炭包制备纯MnO2,制备流程如图所示。
请回答下列问题:
(1)实验前将炭包粉碎,目的是______ 。
(2)加入Na2CO3溶液后发生反应的基本反应类型为复分解反应,方程式为______ ;过滤Ⅱ后洗涤滤渣,证明滤渣已洗净的方法是______ 。
(3)试根据化学方程式求46.0gMnCO3通过焙烧最多制得的MnO2的质量是______ 。
(4)焙烧MnCO3的过程中,固体产物的质量和成分随温度的变化如下图所示,则焙烧MnCO3制取MnO2应该控制反应温度不高于______ ℃;若把焙烧46.0gMnCO3温度控制在900℃,充分反应后的固体产物质量为______ g。
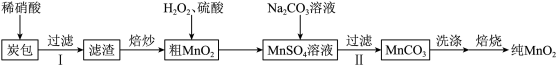

请回答下列问题:
(1)实验前将炭包粉碎,目的是
(2)加入Na2CO3溶液后发生反应的基本反应类型为复分解反应,方程式为
(3)试根据化学方程式求46.0gMnCO3通过焙烧最多制得的MnO2的质量是
(4)焙烧MnCO3的过程中,固体产物的质量和成分随温度的变化如下图所示,则焙烧MnCO3制取MnO2应该控制反应温度不高于
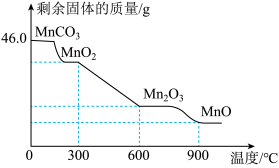
您最近一年使用:0次
2024九年级下·全国·专题练习
解题方法
10 . “页岩气”是蕴藏在岩层中的天然气,被誉为未来能源的“明星”。
(1)天然气的主要成分是甲烷。甲烷中碳的质量分数是______ ,它是一种最简单的_______ (填“无机化合物”或“有机化合物”)。
(2)CH4在空气中燃烧的能量转化形式主要是化学能转化为______ 能,而CH4﹣O2燃料电池则是将化学能转化为______ 能的装置。
(3)天然气是重要的化工原料,一定条件下CH4与CO2反应生成CO和H2,该反应化学方程式是______ 。
(1)天然气的主要成分是甲烷。甲烷中碳的质量分数是
(2)CH4在空气中燃烧的能量转化形式主要是化学能转化为
(3)天然气是重要的化工原料,一定条件下CH4与CO2反应生成CO和H2,该反应化学方程式是
您最近一年使用:0次



