解题方法
1 . 2021年11月初,世界气候峰会在英国举行,为减少环境污染,减少化石能源的使用,开发新型、清洁、可再生能源迫在眉睫。
(1)甲醇、乙醇来源丰富、燃烧热值高,可作为能源使用。其中一种可减少空气中CO2的甲醇合成方法为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
①若将一定量的CO2和H2投入1.0L恒容密闭容器中合成甲醇,实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。则该反应的正反应为_______ (填“放热”或“吸热”)反应,在p2及512K时,图中N点处平衡向_______ (填“正向”或“逆向”)移动;

②若将物质的量之比为1:3的CO2和H2充入体积为1.0L的恒容密闭容器中反应,不同压强下CO2转化率随温度的变化关系如下图所示。
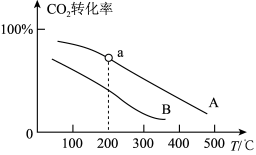
a.A、B两条曲线的压强分别为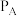 、
、 ,则
,则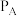
_______  (填“>”“<”或“=”);
(填“>”“<”或“=”);
b.若A曲线条件下,起始充入CO2和H2的物质的量分别为lmol、3mol,且a点时的K=300(L2/mol2),则a点对应CO2转化率为_______ 。
(2)在工业生产中也用反应CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2kJ·mol-1制取H2,从而获得氢能源,该反应需要加入催化剂,若用[M]表示催化剂,则反应历程可表示为:
第一步:[M]+H2O(g)=[M]O+H2(g)
第二步:[M]O+CO(g)=[M]+CO2(g)
①第二步比第一步反应慢,则第二步反应的活化能比第一步_______ (填“大”或“小”)。反应过程中,中间产物[M]O的能量比产物的能量_______ (填“高”或“低”);
②研究表明,此反应的速率方程为 ,式中)
,式中)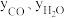 、
、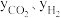 分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,该反应的Kp
分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,该反应的Kp_______ (填“增大”或“减小”)。根据速率方程分析,T>Tm时v逐渐减小的原因是_______ 。

(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。阳极的电极反应式为____ ,若装置中消耗标准状态下O244.8L,理论上能制得碳酸二甲酯的质量____ g。

(1)甲醇、乙醇来源丰富、燃烧热值高,可作为能源使用。其中一种可减少空气中CO2的甲醇合成方法为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
①若将一定量的CO2和H2投入1.0L恒容密闭容器中合成甲醇,实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。则该反应的正反应为

②若将物质的量之比为1:3的CO2和H2充入体积为1.0L的恒容密闭容器中反应,不同压强下CO2转化率随温度的变化关系如下图所示。

a.A、B两条曲线的压强分别为
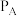 、
、 ,则
,则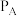
 (填“>”“<”或“=”);
(填“>”“<”或“=”);b.若A曲线条件下,起始充入CO2和H2的物质的量分别为lmol、3mol,且a点时的K=300(L2/mol2),则a点对应CO2转化率为
(2)在工业生产中也用反应CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2kJ·mol-1制取H2,从而获得氢能源,该反应需要加入催化剂,若用[M]表示催化剂,则反应历程可表示为:
第一步:[M]+H2O(g)=[M]O+H2(g)
第二步:[M]O+CO(g)=[M]+CO2(g)
①第二步比第一步反应慢,则第二步反应的活化能比第一步
②研究表明,此反应的速率方程为
 ,式中)
,式中)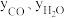 、
、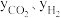 分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,该反应的Kp
分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,该反应的Kp
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。阳极的电极反应式为

您最近半年使用:0次
名校
解题方法
2 . (1)恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
①若反应某时刻t时,n(N2)=13mol,n(NH3)=6mol,则a=_____ mol;
②反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量_____ ;
③原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平)=_____ ;
④原混合气体中,a∶b=_____ ;
⑤达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)=______ ;平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=_____ 。
(2)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH--6e-=CO32-+6H2O。则下列说法正确的是______ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
 2NH3(g)
2NH3(g)①若反应某时刻t时,n(N2)=13mol,n(NH3)=6mol,则a=
②反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量
③原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平)=
④原混合气体中,a∶b=
⑤达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)=
(2)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH--6e-=CO32-+6H2O。则下列说法正确的是
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
您最近半年使用:0次



