名校
解题方法
1 . 某小组探究 溶液对氯水漂白性的影响,装置如下图所示。
溶液对氯水漂白性的影响,装置如下图所示。
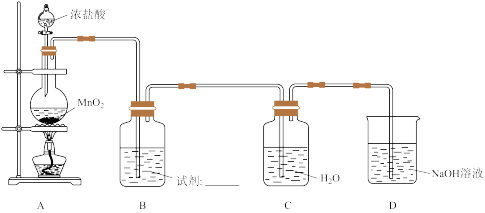
(1)A中反应的离子方程式是_______ 。
(2)B中试剂是_______ 。
(3)用化学方程式表示D中 溶液的作用
溶液的作用_______ 。
(4)取C中氯水,进行实验:向溶液a中加入 氯水。
氯水。
Ⅱ中品红褪色慢,推测可能发生了 ,导致Ⅱ中
,导致Ⅱ中 减少。分析沉淀中含
减少。分析沉淀中含 ,探究如下:将沉淀滤出、洗涤。向沉淀中加入盐酸,产生黄绿色气体。
,探究如下:将沉淀滤出、洗涤。向沉淀中加入盐酸,产生黄绿色气体。
①说明 具有
具有_______ 性。
②产生黄绿色气体的化学方程式是_______ 。
③实验发现,沉淀经几次洗涤后,加入盐酸,不再产生黄绿色气体。
(5)Ⅱ中溶液仍具有漂白性,可能是所加 溶液不足量。
溶液不足量。
①取Ⅱ中上层清液,_______ ,证实所加 溶液过量。
溶液过量。
②Ⅱ中溶液仍具有漂白性的原因是_______ 。
(6)进一步证实Ⅱ中所得沉淀中含 :向沉淀中加入饱和
:向沉淀中加入饱和 溶液,静置、过滤,滤渣、滤液备用。
溶液,静置、过滤,滤渣、滤液备用。
资料: 在一定条件下可转化为
在一定条件下可转化为
①实验证实滤渣中无 。
。
②取滤液,_______ 。
以上实验说明,所得沉淀中含 。
。
 溶液对氯水漂白性的影响,装置如下图所示。
溶液对氯水漂白性的影响,装置如下图所示。
(1)A中反应的离子方程式是
(2)B中试剂是
(3)用化学方程式表示D中
 溶液的作用
溶液的作用(4)取C中氯水,进行实验:向溶液a中加入
 氯水。
氯水。| 序号 | 溶液a | 现象 |
| Ⅰ | 1滴品红 | 几秒后品红褪色 |
| Ⅱ | 1滴品红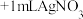 溶液 溶液 | 几分钟后品红褪色,产生白色沉淀 |
 ,导致Ⅱ中
,导致Ⅱ中 减少。分析沉淀中含
减少。分析沉淀中含 ,探究如下:将沉淀滤出、洗涤。向沉淀中加入盐酸,产生黄绿色气体。
,探究如下:将沉淀滤出、洗涤。向沉淀中加入盐酸,产生黄绿色气体。①说明
 具有
具有②产生黄绿色气体的化学方程式是
③实验发现,沉淀经几次洗涤后,加入盐酸,不再产生黄绿色气体。
(5)Ⅱ中溶液仍具有漂白性,可能是所加
 溶液不足量。
溶液不足量。①取Ⅱ中上层清液,
 溶液过量。
溶液过量。②Ⅱ中溶液仍具有漂白性的原因是
(6)进一步证实Ⅱ中所得沉淀中含
 :向沉淀中加入饱和
:向沉淀中加入饱和 溶液,静置、过滤,滤渣、滤液备用。
溶液,静置、过滤,滤渣、滤液备用。资料:
 在一定条件下可转化为
在一定条件下可转化为
①实验证实滤渣中无
 。
。②取滤液,
以上实验说明,所得沉淀中含
 。
。
您最近一年使用:0次
2023-01-05更新
|
748次组卷
|
2卷引用:北京市朝阳区2022-2023学年高一上学期期末统一检测化学试卷
名校
2 . 金属钒被誉为“合金的维生素",常用于催化剂和新型电池。工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:、

[资料]:+5价钒在溶液中的主要存在形式与溶液pH的关系:
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是_________ 。
(2)酸浸:
①Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH = 4,Ca(VO3)2溶于盐酸的离子方程式_______ 。
②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%, 根据下图推测,酸浸时不选择更高酸度的原因是______________ 。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:

①浸出液中加入石灰乳的作用是______________ 。
②向(NH)3VO4溶液中加入NH4C1溶液,控制溶液的pH=7.5。当pH>8时,_______ (用离子反应式表示)。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,配成200 mL (VO2)2SO4溶液,取20 mL溶液置于锥形瓶中,再加入b1 mL c1 mol·L-1 (NE4)2Fe(SO4)2,溶液( +2H++Fe2+ =VO2++Fe3++H2O)。最后用c2 mol.L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至
+2H++Fe2+ =VO2++Fe3++H2O)。最后用c2 mol.L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至__________ (填现象),表示到达滴定终点,消耗KMnO4溶液的体积为b2 mL。已知 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是________ 。如果所用的(NH4)2Fe(SO4)2溶液因露空放置太久而变质,会导致测定的结果__________ (填"偏大"、“不变"或“偏小")。

[资料]:+5价钒在溶液中的主要存在形式与溶液pH的关系:
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  | 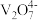 | 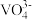 |
(2)酸浸:
①Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH = 4,Ca(VO3)2溶于盐酸的离子方程式
②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%, 根据下图推测,酸浸时不选择更高酸度的原因是

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:

①浸出液中加入石灰乳的作用是
②向(NH)3VO4溶液中加入NH4C1溶液,控制溶液的pH=7.5。当pH>8时,
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,配成200 mL (VO2)2SO4溶液,取20 mL溶液置于锥形瓶中,再加入b1 mL c1 mol·L-1 (NE4)2Fe(SO4)2,溶液(
 +2H++Fe2+ =VO2++Fe3++H2O)。最后用c2 mol.L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至
+2H++Fe2+ =VO2++Fe3++H2O)。最后用c2 mol.L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
您最近一年使用:0次
解题方法
3 . 铜、铁及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应(已知1 molCu2S失去10mol的电子),写出该反应的离子方程式____________________________ 。
(2)工业上利用废铜屑、废酸(含硝酸、硫酸)为主要原料制备硫酸铜晶体。某含有c(HNO3)="2" mol·L—1,c(H2SO4)="4" mol·L—1的废酸混合液100 mL(不含其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4·5H2O)的质量为______________ 。
(3)现有一块含有铜绿的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。(已知:金属生锈率= )
)
①上述铜片中铜的生锈率为________________ (结果保留2位有效数字)
②固态铜与适量氧气反应,能量变化如下图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式____________________________ 。

(4)高铁酸盐在能源环保等领域有广泛用途,如高铁酸钾(K2FeO4) 因有强氧化性,能杀菌消毒,产生Fe(OH)3有吸附性,是一种新型净水剂,用如下图所示的装置可以制取少量的高铁酸钾。
(已知爱迪生蓄电池的反应式为: )
)

①爱迪生蓄电池的负极材料是______________________
②写出制取高铁酸钾阳极的电极反应式______________________
③当生成19.8g的K2FeO4时,隔膜两侧电解液的质量变化差(△m右一△m左)为______________ g。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应(已知1 molCu2S失去10mol的电子),写出该反应的离子方程式
(2)工业上利用废铜屑、废酸(含硝酸、硫酸)为主要原料制备硫酸铜晶体。某含有c(HNO3)="2" mol·L—1,c(H2SO4)="4" mol·L—1的废酸混合液100 mL(不含其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4·5H2O)的质量为
(3)现有一块含有铜绿的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。(已知:金属生锈率=
 )
)①上述铜片中铜的生锈率为
②固态铜与适量氧气反应,能量变化如下图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式

(4)高铁酸盐在能源环保等领域有广泛用途,如高铁酸钾(K2FeO4) 因有强氧化性,能杀菌消毒,产生Fe(OH)3有吸附性,是一种新型净水剂,用如下图所示的装置可以制取少量的高铁酸钾。
(已知爱迪生蓄电池的反应式为:
 )
)
①爱迪生蓄电池的负极材料是
②写出制取高铁酸钾阳极的电极反应式
③当生成19.8g的K2FeO4时,隔膜两侧电解液的质量变化差(△m右一△m左)为
您最近一年使用:0次



