1 . 某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
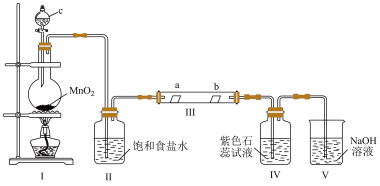
(1)装置Ⅰ中仪器c的名称是___________ ,反应中浓盐酸表现的性质有___________ ,实验室以二氧化锰和浓盐酸制备氯气的化学方程式为___________ 。
(2)装置Ⅱ的作用是___________ 。
(3)若产生Cl2足量,实验过程中装置Ⅳ中的实验现象___________ 。
(4)若Ⅳ中装有淀粉—碘化钾溶液,则观察到的现象是___________ ,写出Ⅳ中反应的离子方程式___________ 。
(5)若Ⅳ中装有硝酸银溶液,则观察到的现象是___________ ,写出Ⅳ中反应的离子方程式___________ 。
(6)写出V装置中发生化学反应的离子方程式:___________ 。
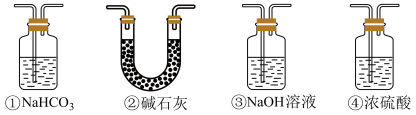
(7)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的___________ 装置(填序号)。

(1)装置Ⅰ中仪器c的名称是
(2)装置Ⅱ的作用是
(3)若产生Cl2足量,实验过程中装置Ⅳ中的实验现象
(4)若Ⅳ中装有淀粉—碘化钾溶液,则观察到的现象是
(5)若Ⅳ中装有硝酸银溶液,则观察到的现象是
(6)写出V装置中发生化学反应的离子方程式:
(7)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的

您最近一年使用:0次
名校
2 . 氯化铁可用作金属蚀刻、有机合成的催化剂。
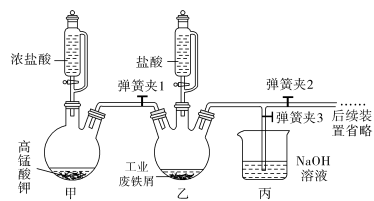

(1)氯化铁晶体的制备:
①实验过程中装置乙发生反应的离子方程式有________________________ ,仪器丙的作用为__________________________ 。
②为顺利达成实验目的,上述装置中弹簧夹打开和关闭的顺序为关闭弹簧夹1和3,打开弹簧夹2;待铁粉完全溶解后打开弹簧夹1和3,关闭弹簧夹2。
③反应结束后,将乙中溶液边加入________ ,边进行加热浓缩、________ 、过滤、洗涤、干燥即得到产品。
(2)氯化铁的性质探究:
某兴趣小组将饱和FeCl3溶液进行加热蒸发、蒸干灼烧,在试管底部得到固体。为进一步探究该固体的成分设计了如下实验。(查阅文献知:①FeCl3溶液浓度越大,水解程度越小 ②氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2 ③FeCl2熔点为670℃)


(1)氯化铁晶体的制备:
①实验过程中装置乙发生反应的离子方程式有
②为顺利达成实验目的,上述装置中弹簧夹打开和关闭的顺序为关闭弹簧夹1和3,打开弹簧夹2;待铁粉完全溶解后打开弹簧夹1和3,关闭弹簧夹2。
③反应结束后,将乙中溶液边加入
(2)氯化铁的性质探究:
某兴趣小组将饱和FeCl3溶液进行加热蒸发、蒸干灼烧,在试管底部得到固体。为进一步探究该固体的成分设计了如下实验。(查阅文献知:①FeCl3溶液浓度越大,水解程度越小 ②氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2 ③FeCl2熔点为670℃)
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因: |
| 关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生该现象的原因: |
| 实验结束,振荡C,静置 | 溶液分层,上层接近无色,下层橙红色 | ③该步操作的离子方程式: |
| 结合以上实验和所学知识,该固体中一定存在的成分有④ | ||
您最近一年使用:0次
名校
3 . 某研究性学习小组利用如图所示的装置制备无水氯化铁。
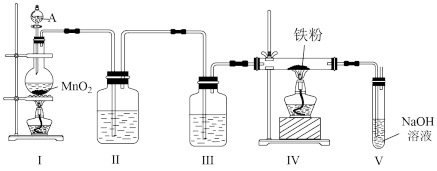
(1)装置Ⅰ中仪器A的名称是_______ ,写出装置Ⅰ中制备氯气的离子方程式_______ 。
(2)装置Ⅱ的作用是_______ 。
(3)写出在装置V中发生的反应的化学方程式_______ 。
(4)实验结束后将装置Ⅳ中的固体加水溶解并过滤,往滤液中滴加KSCN溶液,观察到_______ ,即可证明滤液中含有 。
。
(5)另一组同学发现,在装置Ⅳ和装置Ⅴ之间还需要增加一个装置才能制得无水氯化铁。为了达到这一实验目的,你认为还需在装置Ⅳ和装置Ⅴ之间添加下图中的_______ 装置(填序号)。


(1)装置Ⅰ中仪器A的名称是
(2)装置Ⅱ的作用是
(3)写出在装置V中发生的反应的化学方程式
(4)实验结束后将装置Ⅳ中的固体加水溶解并过滤,往滤液中滴加KSCN溶液,观察到
 。
。(5)另一组同学发现,在装置Ⅳ和装置Ⅴ之间还需要增加一个装置才能制得无水氯化铁。为了达到这一实验目的,你认为还需在装置Ⅳ和装置Ⅴ之间添加下图中的

您最近一年使用:0次
名校
解题方法
4 . 用下列实验装置进行相应实验,装置正确且能达到相应实验目的的是
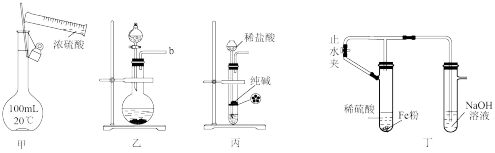

| A.装置甲:用浓硫酸配制一定物质的量浓度的稀硫酸 |
| B.装置乙:浓盐酸与高锰酸钾反应制氯气 |
| C.装置丙:制取纯净的二氧化碳气体 |
| D.装置丁:制备氢氧化亚铁 |
您最近一年使用:0次
2023-01-13更新
|
271次组卷
|
2卷引用:重庆市育才中学校2022-2023学年高一上学期期末考试化学试题
5 . 实验是学习化学、探究化学过程的重要途径。下列装置不能达到相应实验目的的是
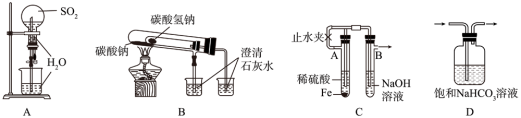

| A.进行喷泉实验 | B.比较 与 与 的热稳定性 的热稳定性 |
C.制备 沉淀 沉淀 | D.除去 中混有的 中混有的 气体 气体 |
您最近一年使用:0次
6 . 氯酸钾(KClO3)和次氯酸钠(NaClO)是氯元素重要的含氧酸盐,实验室中利用下图装置制备这两种盐。
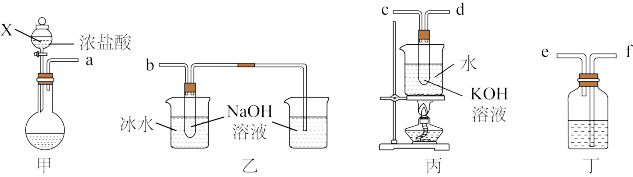
回答下列问题:
(1)仪器X名称是________ ,甲装置圆底烧瓶中的试剂为K2Cr2O7固体,写出发生反应的离子方程式________ 。
(2)为达成实验目的,上述仪器口连接顺序依次为:a-_________ 。
(3)丁装置中所盛试剂为_______ ;乙装置中采用冰水浴冷却的目的是_______ 。
(4)反应结束,取出b中试管,经冷却结晶,_____ ,______ ,干燥,得到KClO3晶体。
(5)为进一步测定所得KClO3晶体的纯度,设计了如下实验方案:
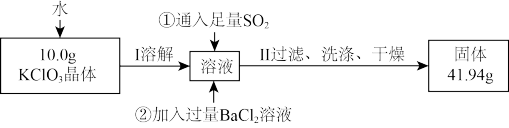
写出通入足量SO2时,溶液中发生反应的离子方程式_________ 。依据上述实验结果,测得该晶体的纯度为_________ 。

回答下列问题:
(1)仪器X名称是
(2)为达成实验目的,上述仪器口连接顺序依次为:a-
(3)丁装置中所盛试剂为
(4)反应结束,取出b中试管,经冷却结晶,
(5)为进一步测定所得KClO3晶体的纯度,设计了如下实验方案:

写出通入足量SO2时,溶液中发生反应的离子方程式
您最近一年使用:0次
名校
解题方法
7 . 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、NH3、CO2为原料先制得NaHCO3,进而生产出纯碱。回答下列问题:
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

(1)装置甲中用稀盐酸与CaCO3反应制备CO2,发现CaCO3与试管内的稀盐酸不能接触,在加稀盐酸时,发现试剂瓶中的稀盐酸已用完,为使反应能顺利进行,可向长颈漏斗中加入的试剂是______________ 。
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(2)乙装置中的试剂是______________ ;丁装置中稀硫酸的作用是______________ 。
(3)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从______________ 管通入 __________ 气体。
(4)有同学建议在戊装置的b管下端连接己装置,理由是______________ 。
(5)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g 水):
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:______________ 。
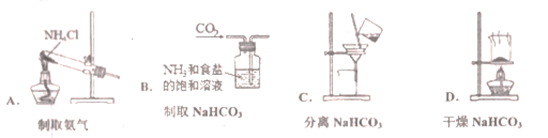
(6)根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是______________ 。
(7)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是______________ (填字母)。
a.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为______________ 。
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

(1)装置甲中用稀盐酸与CaCO3反应制备CO2,发现CaCO3与试管内的稀盐酸不能接触,在加稀盐酸时,发现试剂瓶中的稀盐酸已用完,为使反应能顺利进行,可向长颈漏斗中加入的试剂是
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(2)乙装置中的试剂是
(3)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从
(4)有同学建议在戊装置的b管下端连接己装置,理由是
(5)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g 水):
| 0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(6)根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是

(7)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是
a.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为
您最近一年使用:0次
名校
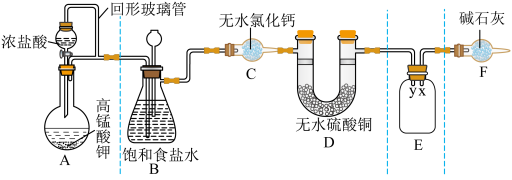
8 . 某同学用 与浓盐酸反应制备纯净的
与浓盐酸反应制备纯净的 的装置如图所示。回答下列问题:
的装置如图所示。回答下列问题:
已知: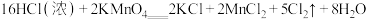
(1)装置A中盛放浓盐酸的仪器名称是
(2)E装置中导管(填“x”或“y”)
(3)装置F的作用有两个:一是
请写出氯气与碱石灰反应的化学方程式
(4)
 、HClO和
、HClO和 三种微粒的物质的量分数随pH(即
三种微粒的物质的量分数随pH(即 )变化的关系如图所示。
)变化的关系如图所示。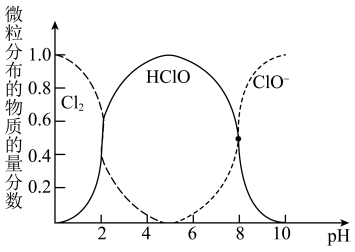
回答问题:①使用84消毒液时为增强消毒效果常调节4<pH<6,原因是
②通常购买的84消毒液pH在12左右,为增强消毒效果可向其中滴加
A.可口可乐 B.稀 C.食醋 D.浓盐酸
C.食醋 D.浓盐酸
(5)实验室将
 通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为
通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为 ,计算此时所得溶液中NaClO的质量分数为
,计算此时所得溶液中NaClO的质量分数为
您最近一年使用:0次
名校
解题方法
9 . 金属铋在工业上常用于制造低熔点合金,用于消防装置、自动喷水器、锅炉等的安全塞,一旦发生火灾,·些水管的活塞会“自动”熔化,喷出水来。由一种铋矿[主要成分为 (不溶于水),含强氧化性杂质
(不溶于水),含强氧化性杂质 等]制备金属铋的简单工艺如图:
等]制备金属铋的简单工艺如图:
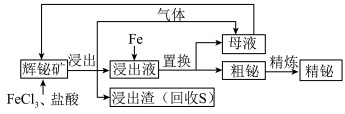
已知:酸性条件下的氧化性: 。
。
(1)“浸出”过程中,溶液中放出的气体是_________ ;放出该气体的离子方程式是________ 。
(2)加入 溶液的目的是
溶液的目的是___________ ,该反应的离子方程式是___________ 。
(3)检验母液中所含有的主要金属阳离子的方法是___________ 。
(4)铋的+5价盐类(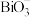 盐)具有强氧化性。欲探究
盐)具有强氧化性。欲探究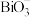 盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的
盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的 溶液,向其中依次加入下列试剂,对应的现象如下表所示:
溶液,向其中依次加入下列试剂,对应的现象如下表所示:
据图回答下面的问题:
①上述试剂的氧化性强弱顺序为:___________ 。
②写出 和
和 反应的离子方程式,并用双线桥法标注电子转移方向
反应的离子方程式,并用双线桥法标注电子转移方向_________ ,已知 不溶于水。)
不溶于水。)
 (不溶于水),含强氧化性杂质
(不溶于水),含强氧化性杂质 等]制备金属铋的简单工艺如图:
等]制备金属铋的简单工艺如图:
已知:酸性条件下的氧化性:
 。
。(1)“浸出”过程中,溶液中放出的气体是
(2)加入
 溶液的目的是
溶液的目的是(3)检验母液中所含有的主要金属阳离子的方法是
(4)铋的+5价盐类(
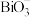 盐)具有强氧化性。欲探究
盐)具有强氧化性。欲探究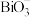 盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的
盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的 溶液,向其中依次加入下列试剂,对应的现象如下表所示:
溶液,向其中依次加入下列试剂,对应的现象如下表所示:| 加入溶液 | ①适量铋酸钠固体 | ②过量的双氧水 | ③加入淀粉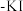 溶液 溶液 |
| 实验现象 | 溶液呈现紫红色 | 紫红色消失,产生气泡 | 溶液变为蓝色 |
①上述试剂的氧化性强弱顺序为:
②写出
 和
和 反应的离子方程式,并用双线桥法标注电子转移方向
反应的离子方程式,并用双线桥法标注电子转移方向 不溶于水。)
不溶于水。)
您最近一年使用:0次
10 . 某实验小组在实验室制备氢氧化亚铁。
(一)制备氢氧化亚铁

(1)仪器g的名称是_______ ,选择上图中的装置制备氢氧化亚铁,连接顺序为_______ (按气流方向,用装置字母表示)。
(2)反应结束后继续通一段时间的N2,目的是_______ ,装置B中发生反应的离子方程式是_______ ,装置C的作用是_______ 。
(二)探究灰绿色沉淀的成因
反应后将装置B中固体过滤时白色沉淀会逐渐转变为灰绿色,实验小组为探究灰绿色沉淀的成因,查阅到以下资料:
i.Fe(OH)2沉淀具有较强的吸附性;
ii.若存在固体杂质,会导致Fe(OH)2沉淀不够紧密,沉淀与溶液的接触面积会更大。
甲同学猜测灰绿色可能是Fe(OH)2吸附Fe2+引起的,设计并完成了实验1~实验3。
(3)依据甲同学的猜测,实验1中沉淀无灰绿色的原因为_______ 。
(4)实验3中立即出现灰绿色浑浊的原因为_______ 。
(5)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件除了隔绝氧气外还有_______ 。
(一)制备氢氧化亚铁

(1)仪器g的名称是
(2)反应结束后继续通一段时间的N2,目的是
(二)探究灰绿色沉淀的成因
反应后将装置B中固体过滤时白色沉淀会逐渐转变为灰绿色,实验小组为探究灰绿色沉淀的成因,查阅到以下资料:
i.Fe(OH)2沉淀具有较强的吸附性;
ii.若存在固体杂质,会导致Fe(OH)2沉淀不够紧密,沉淀与溶液的接触面积会更大。
甲同学猜测灰绿色可能是Fe(OH)2吸附Fe2+引起的,设计并完成了实验1~实验3。
| 实验 | 操作 | 试剂(均为0.1mol/L) | 实验现象 |
| 1 |  向两片玻璃片中心分别滴加试剂,面对面快速夹紧 | i.1滴FeSO4溶液 ii.4滴NaOH溶液 | 玻璃片夹缝中有白色浑浊 |
| 2 | i.4滴FeSO4溶液 ii.1滴NaOH溶液 | 玻璃片夹缝中有白色浑浊,一段时间后变为灰绿色 | |
| 3 | i.2滴FeSO4溶液, 1滴Fe2(SO4)3溶液 ii.2滴NaOH溶液 | 玻璃片夹缝中立即有灰绿色浑浊 |
(3)依据甲同学的猜测,实验1中沉淀无灰绿色的原因为
(4)实验3中立即出现灰绿色浑浊的原因为
(5)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件除了隔绝氧气外还有
您最近一年使用:0次



