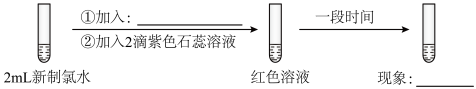
1 . 某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
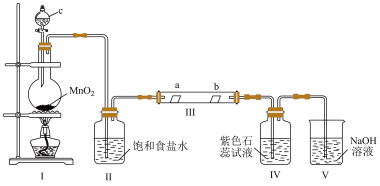
(1)装置Ⅰ中仪器c的名称是___________ ,反应中浓盐酸表现的性质有___________ ,实验室以二氧化锰和浓盐酸制备氯气的化学方程式为___________ 。
(2)装置Ⅱ的作用是___________ 。
(3)若产生Cl2足量,实验过程中装置Ⅳ中的实验现象___________ 。
(4)若Ⅳ中装有淀粉—碘化钾溶液,则观察到的现象是___________ ,写出Ⅳ中反应的离子方程式___________ 。
(5)若Ⅳ中装有硝酸银溶液,则观察到的现象是___________ ,写出Ⅳ中反应的离子方程式___________ 。
(6)写出V装置中发生化学反应的离子方程式:___________ 。
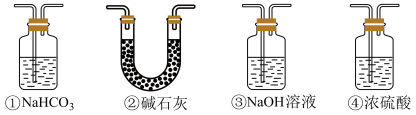
(7)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的___________ 装置(填序号)。

(1)装置Ⅰ中仪器c的名称是
(2)装置Ⅱ的作用是
(3)若产生Cl2足量,实验过程中装置Ⅳ中的实验现象
(4)若Ⅳ中装有淀粉—碘化钾溶液,则观察到的现象是
(5)若Ⅳ中装有硝酸银溶液,则观察到的现象是
(6)写出V装置中发生化学反应的离子方程式:
(7)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的

您最近一年使用:0次
名校
解题方法
2 . 氯气是一种重要的化工原料,在生产生活中有着重要的应用。
(1)某研究小组探究氯气和氯水的漂白性,用浓盐酸与MnO2反应制备氯气,其化学反应方程式为_______ 。生成的氯气通入如图装置,所需装置的接口连接顺序为_______ (填字母序号)。

证明氯水具有漂白性是由于Cl2与H2O反应生成了具有漂白性的物质的实验现象是_______ 。
(2)在用浓盐酸与MnO2混合加热制氯气过程中,发现氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。关于MnO2剩余的原因,该小组提出如下猜想:
猜想ⅰ:随着反应进行,c(H+)降低,Cl-的还原性减弱,不能还原MnO2。
猜想ⅱ:随着反应进行,c(H+)降低,MnO2的氧化性减弱,不能氧化Cl-。
猜想ⅱi:随着反应进行,c(Cl-)降低,Cl-的还原性减弱,不能还原MnO2。
猜想iv:随着反应进行,c(Mn2+)升高,MnO2的氧化性减弱,不能氧化Cl-。
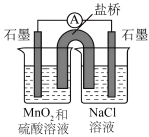
该小组设计原电池装置验证上述猜想,请补充横线部分的内容。(恒温装置未画出)
(1)某研究小组探究氯气和氯水的漂白性,用浓盐酸与MnO2反应制备氯气,其化学反应方程式为

证明氯水具有漂白性是由于Cl2与H2O反应生成了具有漂白性的物质的实验现象是
(2)在用浓盐酸与MnO2混合加热制氯气过程中,发现氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。关于MnO2剩余的原因,该小组提出如下猜想:
猜想ⅰ:随着反应进行,c(H+)降低,Cl-的还原性减弱,不能还原MnO2。
猜想ⅱ:随着反应进行,c(H+)降低,MnO2的氧化性减弱,不能氧化Cl-。
猜想ⅱi:随着反应进行,c(Cl-)降低,Cl-的还原性减弱,不能还原MnO2。
猜想iv:随着反应进行,c(Mn2+)升高,MnO2的氧化性减弱,不能氧化Cl-。
该小组设计原电池装置验证上述猜想,请补充横线部分的内容。(恒温装置未画出)
 | ||||
| 实验编号 | 实验步骤 | 实验现象 | 实验结论 | 实验反思与评价 |
| i | 向右侧烧杯中滴入几滴浓盐酸 | 猜想i成立 | 该操作不能验证猜想i,理由① | |
| ii | ② | ③ | 猜想ii成立 | 正极的电极反应方程式④ |
| …… | ||||
| iv | 在验证了猜想ii和iii均成立以后,向左侧烧杯中加入⑤ | 电流表几乎无示数 | 猜想iv成立 | |
您最近一年使用:0次
3 . 某同学用高锰酸钾和浓盐酸制备氯气,并验证卤族单质间氧化性强弱。实验装置如图所示(夹持装置已省略)。

回答下列问题:
(1)进行该实验前需进行的操作是___________ 。
(2)装置A中发生反应的化学方程式为___________ 。
(3)装置B的作用为___________ 。
(4)打开a,关闭b,装置C中的实验现象为___________ 。可证明氧化性 ;一段时间后,装置C中溶液颜色不变,打开b,关闭a,装置E中溶液由无色逐渐变为蓝色,该同学由此得出结论,氧化性:
;一段时间后,装置C中溶液颜色不变,打开b,关闭a,装置E中溶液由无色逐渐变为蓝色,该同学由此得出结论,氧化性: ,你是否认同该同学的结论,若不认同,给出理由:
,你是否认同该同学的结论,若不认同,给出理由:___________ 。
(5)装置D中足量NaOH溶液中发生反应的离子方程式为___________ 。

回答下列问题:
(1)进行该实验前需进行的操作是
(2)装置A中发生反应的化学方程式为
(3)装置B的作用为
(4)打开a,关闭b,装置C中的实验现象为
 ;一段时间后,装置C中溶液颜色不变,打开b,关闭a,装置E中溶液由无色逐渐变为蓝色,该同学由此得出结论,氧化性:
;一段时间后,装置C中溶液颜色不变,打开b,关闭a,装置E中溶液由无色逐渐变为蓝色,该同学由此得出结论,氧化性: ,你是否认同该同学的结论,若不认同,给出理由:
,你是否认同该同学的结论,若不认同,给出理由:(5)装置D中足量NaOH溶液中发生反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 如图所示是实验室用软锰矿和浓盐酸制备纯净氯气的装置图:

(1)装浓盐酸的仪器名称_______ 。
(2)写出制取氯气的化学方程式_____ ,反应中氧化剂与还原剂的物质的量之比为______ 。
(3)利用上图装置制备并收集纯净的氯气,则装置B中所装试剂为_______ ,其作用是_______ ,装置C中所装试剂的作用是_______ 。
(4)E中所装试剂为_______ ,发生反应的离子方程式为_______ 。
某实验小组对氯水成分和性质进行探究,实验如下:
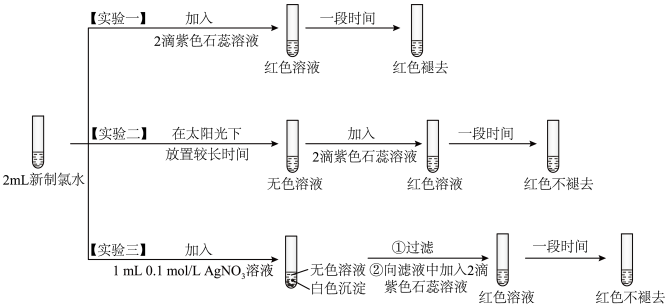
(5)氯水呈黄绿色,说明其中含有_______ (填化学式)。
(6)实验一的现象表明,氯水具有酸性和_______ 性。
(7)氯气与水反应的化学方程式为_______ 。
(8)用化学用语(化学方程式)说明实验二中“红色不褪去”的原因_______ 。
(9)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释所致,补充所加试剂和现象。(实验四)_______ 、_______ 。

(1)装浓盐酸的仪器名称
(2)写出制取氯气的化学方程式
(3)利用上图装置制备并收集纯净的氯气,则装置B中所装试剂为
(4)E中所装试剂为
某实验小组对氯水成分和性质进行探究,实验如下:

(5)氯水呈黄绿色,说明其中含有
(6)实验一的现象表明,氯水具有酸性和
(7)氯气与水反应的化学方程式为
(8)用化学用语(化学方程式)说明实验二中“红色不褪去”的原因
(9)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释所致,补充所加试剂和现象。(实验四)

您最近一年使用:0次
解题方法
5 . 某小组同学为探究Cl2与不同条件下的MnSO4的反应情况。
已知:i.几种锰的化合物颜色:MnO2棕黑色、MnO 绿色、MnO
绿色、MnO 紫色;
紫色;
ii.Mn2+在一定条件下能被Cl2或ClO-氧化成上述某种锰的化合物;
iii.MnO 的氧化性强于MnO2;浓碱条件下,MnO
的氧化性强于MnO2;浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO ;
;
iv.Cl2的氧化性与溶液的酸碱性无关,ClO-的氧化性随碱性增强而减弱。
设计了如图实验装置(夹持装置略),实验过程与现象如表所示。
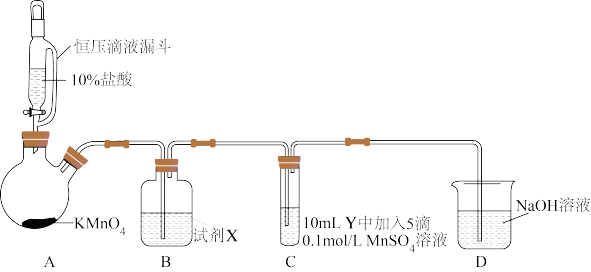
请按要求回答下列问题:
(1)使用KMnO4制备Cl2而不使用MnO2的理由是____ 。
(2)试剂X是____ ;Cl2在B中的反应是可逆的,其证据是____ ;用离子方程式表示装置D的作用:____ 。
(3)对比I-1与I-2的现象,得出氧化性强弱结论:O2____ Cl2(填“<”或“>”或“=”);写出产生I-2现象的离子方程式:____ 。
(4)II-1中白色沉淀为____ ,在空气中变成棕黑色沉淀的原因是____ 。
(5)对比I-2与II-2的现象,得出结论是___ 。
(6)根据已知信息,推测III-2中应得到绿色溶液,但实际与之不符。分析可能的原因有(写一条)____ 。
已知:i.几种锰的化合物颜色:MnO2棕黑色、MnO
 绿色、MnO
绿色、MnO 紫色;
紫色;ii.Mn2+在一定条件下能被Cl2或ClO-氧化成上述某种锰的化合物;
iii.MnO
 的氧化性强于MnO2;浓碱条件下,MnO
的氧化性强于MnO2;浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO ;
;iv.Cl2的氧化性与溶液的酸碱性无关,ClO-的氧化性随碱性增强而减弱。
设计了如图实验装置(夹持装置略),实验过程与现象如表所示。

| 实验序号 | 试管C中Y | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| I | 水 | I-1得到无色溶液 | I-2产生棕黑色沉淀,溶液呈浅黄绿色,放置片刻后无明显现象 |
| II | 5%NaOH溶液 | II-1产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | II-2棕黑色沉淀增多,放置片刻后溶液变为紫色,仍有沉淀 |
| III | 40%NaOH溶液 | III-1产生白色沉淀,在空气中较II-1变成棕黑色沉淀快 | III-2棕黑色沉淀较II-2的增多,放置片刻后溶液变为紫色,仍有沉淀 |
(1)使用KMnO4制备Cl2而不使用MnO2的理由是
(2)试剂X是
(3)对比I-1与I-2的现象,得出氧化性强弱结论:O2
(4)II-1中白色沉淀为
(5)对比I-2与II-2的现象,得出结论是
(6)根据已知信息,推测III-2中应得到绿色溶液,但实际与之不符。分析可能的原因有(写一条)
您最近一年使用:0次
解题方法
6 . 某实验小组用浓盐酸和 制取
制取 并探究其化学性质,设计装置如图:
并探究其化学性质,设计装置如图:
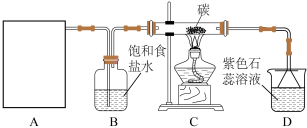
(1)制备 的化学反应离子方程式是
的化学反应离子方程式是_______ ,A是氯气发生装置(省略未画),A装置除了酒精灯、圆底烧瓶外还用到的玻璃仪器有_______
(2)从C装置出来的气体中含有 和HCl,则在C装置中发生的化学反应方程式为
和HCl,则在C装置中发生的化学反应方程式为_______ 。
(3)若装置D中用足量的 溶液吸收多余氯气,试写出相应的离子方程式:
溶液吸收多余氯气,试写出相应的离子方程式:_______ 。
(4)同学们在实验中发现,若用稀盐酸代替浓盐酸与 混合加热没有氯气生成,于是开始探究该条件下不能生成氯气的原因。
混合加热没有氯气生成,于是开始探究该条件下不能生成氯气的原因。
①提出合理假设。
假设1: 的浓度不够大;
的浓度不够大;
假设2:_______ ;
假设3:_______ 。
②设计实验方案,进行实验。在下表中写出实验步骤以及预期现象和结论。_______
限选实验试剂:蒸馏水、浓 固体、
固体、 固体、稀盐酸、
固体、稀盐酸、 溶液、淀粉-KI溶液。
溶液、淀粉-KI溶液。
 制取
制取 并探究其化学性质,设计装置如图:
并探究其化学性质,设计装置如图:
(1)制备
 的化学反应离子方程式是
的化学反应离子方程式是(2)从C装置出来的气体中含有
 和HCl,则在C装置中发生的化学反应方程式为
和HCl,则在C装置中发生的化学反应方程式为(3)若装置D中用足量的
 溶液吸收多余氯气,试写出相应的离子方程式:
溶液吸收多余氯气,试写出相应的离子方程式:(4)同学们在实验中发现,若用稀盐酸代替浓盐酸与
 混合加热没有氯气生成,于是开始探究该条件下不能生成氯气的原因。
混合加热没有氯气生成,于是开始探究该条件下不能生成氯气的原因。①提出合理假设。
假设1:
 的浓度不够大;
的浓度不够大;假设2:
假设3:
②设计实验方案,进行实验。在下表中写出实验步骤以及预期现象和结论。
限选实验试剂:蒸馏水、浓
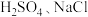 固体、
固体、 固体、稀盐酸、
固体、稀盐酸、 溶液、淀粉-KI溶液。
溶液、淀粉-KI溶液。| 实验步骤 | 预期现象与结论 |
步骤1:取少量1mol/L稀盐酸于试管A中,加入少量 ,_______ ,_______ | _______ |
步骤2:取少量1mol/L稀盐酸于试管B中,加入少量 ,_______ ,_______ | _______ |
您最近一年使用:0次
7 . I.无水四氯化锡(SnCl4)用于制作FTO导电玻璃,FTO导电玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等领域,可用如图所示装置制备四氯化锡。
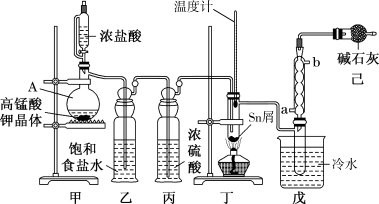
有关信息如下表所示:
(1)仪器A中发生反应的化学方程为_______ 。
(2)将装置按图示连接好,先检在装置的气密性,再慢慢滴入浓盐酸,待观察到装置丁内充满黄绿色气体后,开始加热装置丁。如果缺少装置乙,装置丁内还可能发生的副反应的化学方程式为_______ ,装置已的作用是_______ 。
II.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了以下实验:
i.实验需要90mL0.10mol·L-1FeBr2溶液
(3)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需要的玻璃仪器是_______ 。
(4)下列有关配制过程的说法正确的是_______(填序号)。
ii.探究FeBr2的还原性。取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(5)请你完成下表,验证假设
已知:①Br2易溶于有机溶剂四氯化碳(CCl4)且所得溶液呈橙红色;②四氯化碳(CCl4)不溶于水且密度比水大。
(6)若假设2正确,向20L上述浓度的FeBr2溶液中通入标准状况下56LCl2,反应的离子方程式为_______ 。

有关信息如下表所示:
| 化学式 | Sn | SnCl2 | SnCl4 |
| 熔点/°C | 232 | 247 | -34 |
| 沸点/°C | 2602 | 623 | 114 |
| 其他性质 | 银白色固体 | 无色晶体,Sn2+易被Fe3+、I2等氧化为Sn4+ | 无色液体,易溶于水并能与水反应 |
(2)将装置按图示连接好,先检在装置的气密性,再慢慢滴入浓盐酸,待观察到装置丁内充满黄绿色气体后,开始加热装置丁。如果缺少装置乙,装置丁内还可能发生的副反应的化学方程式为
II.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了以下实验:
i.实验需要90mL0.10mol·L-1FeBr2溶液
(3)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需要的玻璃仪器是
(4)下列有关配制过程的说法正确的是_______(填序号)。
| A.用托盘天平称量质量为1.944g的FeBr2 |
| B.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解 |
| C.洗涤溶解FeBr2的烧杯和玻璃棒,并将洗涤液转移至容量瓶中 |
| D.容量瓶贴签存放配好的FeBr2溶液 |
ii.探究FeBr2的还原性。取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(5)请你完成下表,验证假设
已知:①Br2易溶于有机溶剂四氯化碳(CCl4)且所得溶液呈橙红色;②四氯化碳(CCl4)不溶于水且密度比水大。
| 实验步骤、预期现象 | 结论 |
| ①取适量溶液于试管中,向其中加入 现象:溶液分层,下层呈橙红色,上层呈无色 | 假设1正确 |
| ②另取适量溶液于试管中,向其中加入 现象:溶液变为红色 | 假设2正确 |
您最近一年使用:0次
名校
解题方法
8 . 一氧化二氯(Cl2O)是一种工业上常用的氯化剂和氧化剂,还可用作灭菌和漂白。常压下,Cl2O的熔点为-120.6°C,沸点为3.5°C,遇水会发生反应。某化学实验小组用纯碱和氯气利用下图中装置制备Cl2O(夹持装置、装置C中的冷却装置或加热装置均略去)。

回答下列问题:
(1)分液漏斗使用前必须进行的操作为_______ ,欲使分液漏斗内的浓盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或_______ 。
(2)装置的正确连接顺序是_______ (按气流方向,用小写字母表示)。
(3)装置C中发生Cl2O的制备反应中的固体产物为NaHCO3和NaCl,写出该反应的化学方程式_______ 。反应一段时间后,装置B中观察到的实验现象为_______ 。
(4)研究表明,装置B中Cl2O的收率与装置C的温度和纯碱的含水量的关系如下表所示:
本实验中适宜选用的温度范围和纯碱的含水量分别为_______ 、_______ 。
(5)装置F中盛放碱石灰的仪器名称为_______ ,碱石灰的作用为_______ 。
(6)若将少量Cl2O气体通入用稀硫酸酸化的KI-淀粉溶液中,溶液会变蓝色,溶液变蓝色的原因为_______ (用离子方程式表示)。

回答下列问题:
(1)分液漏斗使用前必须进行的操作为
(2)装置的正确连接顺序是
(3)装置C中发生Cl2O的制备反应中的固体产物为NaHCO3和NaCl,写出该反应的化学方程式
(4)研究表明,装置B中Cl2O的收率与装置C的温度和纯碱的含水量的关系如下表所示:
| 温度/°C | 纯碱中含水量/% | Cl2O的收率/% |
| 0~10 | 5.44 | 67.85 |
| 0~10 | 7.88 | 89.26 |
| 10~20 | 8.00 | 64.24 |
| 30~40 | 10.25 | 52.63 |
| 30~40 | 12.50 | 30.38 |
(5)装置F中盛放碱石灰的仪器名称为
(6)若将少量Cl2O气体通入用稀硫酸酸化的KI-淀粉溶液中,溶液会变蓝色,溶液变蓝色的原因为
您最近一年使用:0次
2022-06-27更新
|
293次组卷
|
2卷引用:河南省联盟2022届高三下学期(5月)模拟考试理科综合化学试题
解题方法
9 . 某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并回答下列问题:
【查阅资料】含有Fe3+的盐溶液遇到KSCN溶液时变成红色,含有Fe2+的盐溶液遇到KSCN溶液时不变色。
探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为____ 。
(2)装置D的作用是____ 。
探究二:设计如图实验方案确定反应后硬质玻璃管B中黑色固体的成分(已知酸性KMnO4溶液能与盐酸发生反应)。
(3)待硬质玻璃管B冷却后,取少许其中的固体继续进行如图实验:
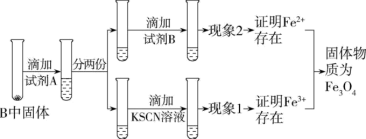
①试剂B是____ ,现象2为____ 。
②若现象1为溶液未变红色,请从硬质玻璃管B中固体物质的成分分析可能的原因:____ 。
探究三:某学习小组设计用硬质玻璃管B中固体制备Fe3O4纳米材料的流程示意图如图:

已知:①浊液B中铁元素以FeOOH形式存在;
②在操作Ⅰ中,相同条件下测得Fe3O4的产率与R[R=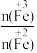 ]的关系如图所示。
]的关系如图所示。

(4)在滤液A转化为浊液B反应完成后需再加热一段时间除去剩余H2O2,目的是____ 。
(5)设浊液B中FeOOH的物质的量为amol,滤液A中的n(Fe)=bmol。为使Fe3O4的产率最高,则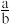 =
=____ 。(填数值,保留3位有效数字)
【查阅资料】含有Fe3+的盐溶液遇到KSCN溶液时变成红色,含有Fe2+的盐溶液遇到KSCN溶液时不变色。
探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为
(2)装置D的作用是
探究二:设计如图实验方案确定反应后硬质玻璃管B中黑色固体的成分(已知酸性KMnO4溶液能与盐酸发生反应)。
(3)待硬质玻璃管B冷却后,取少许其中的固体继续进行如图实验:

①试剂B是
②若现象1为溶液未变红色,请从硬质玻璃管B中固体物质的成分分析可能的原因:
探究三:某学习小组设计用硬质玻璃管B中固体制备Fe3O4纳米材料的流程示意图如图:

已知:①浊液B中铁元素以FeOOH形式存在;
②在操作Ⅰ中,相同条件下测得Fe3O4的产率与R[R=
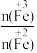 ]的关系如图所示。
]的关系如图所示。
(4)在滤液A转化为浊液B反应完成后需再加热一段时间除去剩余H2O2,目的是
(5)设浊液B中FeOOH的物质的量为amol,滤液A中的n(Fe)=bmol。为使Fe3O4的产率最高,则
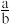 =
=
您最近一年使用:0次
10 . 实验室有不纯的过氧化钠,欲用排水法测量其纯度,准确称量该样品8.0克装入C装置中。实验操作如下,请完成下列问题:
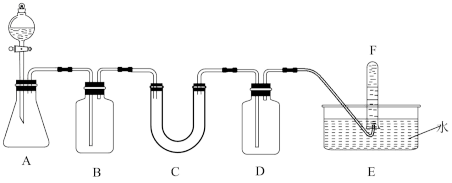
(1)A是实验室常见制备 的装置,锥形瓶内盛有某不溶于水的块状固体,锥形瓶上方盛装盐酸的仪器名称:
的装置,锥形瓶内盛有某不溶于水的块状固体,锥形瓶上方盛装盐酸的仪器名称:_______ , 锥形瓶内发生反应的离子方程式为_______ 。
(2)填写下表中的空白
(3)写出C装置中主要反应的化学方程式:_______ 。
(4)欲检验F中收集的气体,其具体操作步骤及现象:_______ 。
(5)缓缓通入过量的 后,收集到气体为1120.0mL(标准状况下),则过氧化钠的纯度为
后,收集到气体为1120.0mL(标准状况下),则过氧化钠的纯度为_______ %(三位有效数字)。

(1)A是实验室常见制备
 的装置,锥形瓶内盛有某不溶于水的块状固体,锥形瓶上方盛装盐酸的仪器名称:
的装置,锥形瓶内盛有某不溶于水的块状固体,锥形瓶上方盛装盐酸的仪器名称:(2)填写下表中的空白
| 装置编号 | 加入试剂 | 加入该试剂的目的 |
| B | ||
| D |
(4)欲检验F中收集的气体,其具体操作步骤及现象:
(5)缓缓通入过量的
 后,收集到气体为1120.0mL(标准状况下),则过氧化钠的纯度为
后,收集到气体为1120.0mL(标准状况下),则过氧化钠的纯度为
您最近一年使用:0次
2022-01-25更新
|
314次组卷
|
3卷引用:湖北省部分市州2021-2022学年高一上学期期末联合调研考试化学试题
湖北省部分市州2021-2022学年高一上学期期末联合调研考试化学试题(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)河南省沈丘县长安高级中学2022-2023学年高一上学期期中考试化学试题



