名校
1 . 二氧化氯(ClO2)具有强氧化性,是优良的饮用水消毒剂。ClO2常温下为黄绿色气体,熔点-59℃,沸点11℃,极易溶于水且不与水反应,浓的ClO2受热时易爆炸。我国广泛使用的方法是用干燥的Cl2与NaClO2固体反应制取ClO2,实验室模拟制备ClO2装置如图所示:
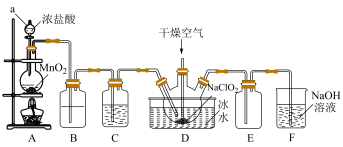
(1)仪器a的名称是:___________ ,装置A中反应的离子方程式为:___________ 。
(2)装置B中盛装的试剂是___________ ,装置C中试剂的作用是:___________ 。
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②___________ 。
(4)装置E为ClO2的收集装置,应将其置于___________ 水浴中(填“热”或“冰”)。
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:___________ 。
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若___________ (填“实验现象”),则假设1成立。

(1)仪器a的名称是:
(2)装置B中盛装的试剂是
(3)为防止ClO2制备装置发生爆炸,实验中采取的措施:①将装置置于冰水浴中降温,②
(4)装置E为ClO2的收集装置,应将其置于
(5)装置F为氯气的尾气吸收装置,小组同学用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色突然褪去,小组同学对褪色原因提出假设:
假设1:
假设2:可能是氯水中存在HClO具有强氧化性,漂白褪色。
该小组同学设计实验证明假设1是否成立。实验方案为:取少许褪色后的溶液于试管中,滴加足量的NaOH溶液,若
您最近一年使用:0次
2023-11-06更新
|
632次组卷
|
2卷引用:宁夏银川市第二中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
2 . 无水四氯化锡(SnC14)是一种用途广泛的化工中间体,常用作媒染剂和有机合成的氯化催化剂。熔融的金属锡(熔点231℃)在300℃左右能直接与Cl2作用生成无水四氯化锡,实验室装置如图所示:
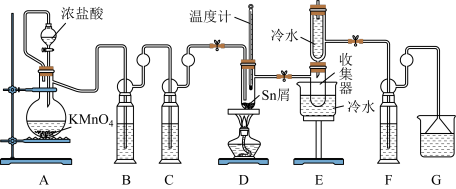
已知信息如下:①将金属锡熔融,通入干燥氯气进行反应,生成四氯化锡。②无水四氯化锡是无色易流动的液体,熔点为一33℃,沸点为114.1℃。二氯化锡是无色晶体,熔点为246℃,沸点为652℃。③无水四氯化锡在空气中极易水解,水解产物之一是SnO2.xH2O,并产生白烟。请回答下列问题:
(l)开始实验前一定要____ ,E中冷水的作用是___ 。
(2)装置F中盛放的最佳试剂为___ ,作用是____ 。
(3)实验时应先打开A处分液漏斗旋塞和整套装置的阀门,待观察到____ 这一现象时,再点燃D处酒精灯。
(4)若撤去装置C,则D中还可能发生反应的化学方程式为__ 。
(5)Cl2和锡作用即可生成SnC14,也会生成SnCl2,为减少SnCl2的生成,可采取的措施是_______ .
(6)得到的产物中常含有杂质SnCl2,SnCl2是常用的还原剂。某实验小组用碘氧化法滴定分析产品中杂质SnCl2的质量分数。准确称取a克该样品于锥形瓶,用适量浓盐酸溶解,淀粉溶液作指示剂,c mol.L-l碘标准溶液滴定至终点,消耗标准液20. 00mL,已知滴定原理是:SnCl2+2HCl+I2=SnC14+2HI,则产品中杂质SnCl2的质量分数为____ (用含a、c的代数式表示);即使此法测定的操作均正确,但测得的SnCl2含量仍低于实际含量,其原因可能是________ (用离子方程式表示)。

已知信息如下:①将金属锡熔融,通入干燥氯气进行反应,生成四氯化锡。②无水四氯化锡是无色易流动的液体,熔点为一33℃,沸点为114.1℃。二氯化锡是无色晶体,熔点为246℃,沸点为652℃。③无水四氯化锡在空气中极易水解,水解产物之一是SnO2.xH2O,并产生白烟。请回答下列问题:
(l)开始实验前一定要
(2)装置F中盛放的最佳试剂为
(3)实验时应先打开A处分液漏斗旋塞和整套装置的阀门,待观察到
(4)若撤去装置C,则D中还可能发生反应的化学方程式为
(5)Cl2和锡作用即可生成SnC14,也会生成SnCl2,为减少SnCl2的生成,可采取的措施是
(6)得到的产物中常含有杂质SnCl2,SnCl2是常用的还原剂。某实验小组用碘氧化法滴定分析产品中杂质SnCl2的质量分数。准确称取a克该样品于锥形瓶,用适量浓盐酸溶解,淀粉溶液作指示剂,c mol.L-l碘标准溶液滴定至终点,消耗标准液20. 00mL,已知滴定原理是:SnCl2+2HCl+I2=SnC14+2HI,则产品中杂质SnCl2的质量分数为
您最近一年使用:0次
2020-04-17更新
|
977次组卷
|
6卷引用:宁夏石嘴山市第三中学2022-2023学年高三上学期期中考试化学试题
宁夏石嘴山市第三中学2022-2023学年高三上学期期中考试化学试题河南省六市2020届高三第一次联合调研监测(全国I卷)理综化学试题河南省六市(南阳市、驻马店市、信阳市、漯河市、周口市、三门峡市)2020届高三第一次模拟调研理科综合化学试题四川省成都石室中学高2020届第三次高考适应性考试理综化学试题(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(精练)-2022年高考化学一轮复习讲练测(已下线)秘籍20 制备实验-备战2022年高考化学抢分秘籍(全国通用)
3 . 在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
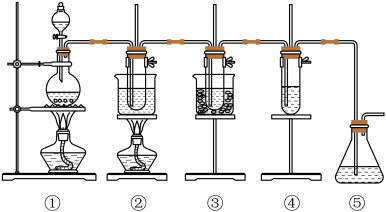
图中:①为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中;③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰.通过_______________________ (坡写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_____________________ (填写下列编号字母)的净化装置。
(2)比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
______________________________________________________
反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是_____________________ (填写编号字母);从②的试管中分离出该晶体的方法是____________________ (填写实验操作名称)

(3)本实验中制取次氯酸钠的离子方程式是:
___________________________________________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:

图中:①为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中;③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰.通过
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是

(3)本实验中制取次氯酸钠的离子方程式是:
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变为 |
您最近一年使用:0次
2019-01-30更新
|
1491次组卷
|
7卷引用:宁夏石嘴山三中2016届高三(上)第四次质检化学试卷(解析版)
宁夏石嘴山三中2016届高三(上)第四次质检化学试卷(解析版)2007年普通高等学校招生全国统一考试(四川卷)理综化学部分(已下线)2012届内蒙古巴彦淖尔市中学巴市一中高三上学期12月月考理综试卷(化学部分)(已下线)2014届浙江省杭州二中高三上学期第二次月考化学试卷(已下线)2013-2014浙江省宁波效实中学高一下学期期末考试化学试卷山东省单县第五中学2016-2017学年高一下学期6月月考化学试题(已下线)上海黄浦区2011届高三一模化学试题
名校
解题方法
4 . 铬元素及其化合物在生产、生活中具有广泛的用途。醋酸亚铬水合物{[Cr(CH3COO)2]2⋅2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价络(二价铬不稳定,极易被氧气氧化)
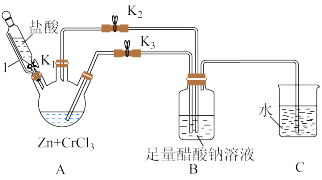
(1)仪器1的名称是___________ ,该装置的优点是 ___________ 。
(2)本实验中所用的溶液,配制用的蒸馏水都需事先煮沸,同时还要与C装置相连___________ 。
(3)本实验中锌粒要过量,其原因除了锌与CrCl3充分反应得到CrCl2外,另一个作用是___________ 。
(4)实验中,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应___________ 阀门K2、___________ 阀门K3(填“打开”或“关闭”)。
(5)为洗涤[Cr(CH3COO)2]2⋅2H2O产品,下列方法中最适合的是 ___________。
(6)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质6.34g,实验后得干燥纯净的[Cr(CH3COO)2]2⋅2H2O5.64g,请计算该实验所得产品的产率___________ 。

(1)仪器1的名称是
(2)本实验中所用的溶液,配制用的蒸馏水都需事先煮沸,同时还要与C装置相连
(3)本实验中锌粒要过量,其原因除了锌与CrCl3充分反应得到CrCl2外,另一个作用是
(4)实验中,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应
(5)为洗涤[Cr(CH3COO)2]2⋅2H2O产品,下列方法中最适合的是 ___________。
| A.先用盐酸洗,后用冷水洗 |
| B.先用冷水洗,后用乙醇洗 |
| C.先用冷水洗,后用乙醚洗 |
| D.先用乙醇洗涤,后用乙醚洗 |
(6)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质6.34g,实验后得干燥纯净的[Cr(CH3COO)2]2⋅2H2O5.64g,请计算该实验所得产品的产率
您最近一年使用:0次
5 . 实验室用如图装置制备无水FeCl3。

已知:FeCl3固体易升华,易吸收水分而潮解变质。请回答下列问题:
(1)连接好仪器后首先应进行的操作是_______ ;A装置中连接分液漏斗与烧瓶之间的导管的作用是_______ 。
(2)请写出A装置中反应的离子方程式_______ 。
(3)实验室还可用KMnO4和浓盐酸反应制取氯气:2KMnO4+l6HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,在上述反应中,生成56LCl2(标准状况下),转移电子的个数为_______ 。
(4)写出工业制取漂白粉的化学方程式_______ 。
(5)装置B中长颈漏斗可以检验后续装置是否堵塞,其中饱和食盐水的作用是_______ ,D装置与E装置之间用弧形粗弯管连接而不是普通的直角玻璃导管,其目的是_______ 。
(6)F中所装试剂为_______ ,有学生提出:装置F和G二者可以简约用一个球形干燥管来代替,为了达到相同的作用,球形干燥管内盛放的试剂是_______ 。

已知:FeCl3固体易升华,易吸收水分而潮解变质。请回答下列问题:
(1)连接好仪器后首先应进行的操作是
(2)请写出A装置中反应的离子方程式
(3)实验室还可用KMnO4和浓盐酸反应制取氯气:2KMnO4+l6HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,在上述反应中,生成56LCl2(标准状况下),转移电子的个数为
(4)写出工业制取漂白粉的化学方程式
(5)装置B中长颈漏斗可以检验后续装置是否堵塞,其中饱和食盐水的作用是
(6)F中所装试剂为
您最近一年使用:0次
6 . 在实验室采用如图装置制备气体,合理的是
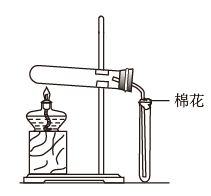
| 化学试剂 | 制备的气体 | |
| A | 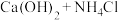 |  |
| B | 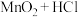 (浓) (浓) |  |
| C | 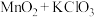 |  |
| D | 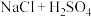 (浓) (浓) |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-09更新
|
21818次组卷
|
50卷引用:宁夏中卫市中宁县第一中学2021-2022学年高三上学期第一次月考化学试题
宁夏中卫市中宁县第一中学2021-2022学年高三上学期第一次月考化学试题2021年高考全国乙卷化学真题河南省三门峡市实验高中2020-2021学年高二下学期6月月考化学试题河北省辛集中学 2020-2021学年高二下学期期末考试化学试题(已下线)第29讲 化学综合实验(精练)-2022年高考化学一轮复习讲练测(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)山西省实验中学2021-2022学年高二下学期开学分班素质测试化学试题(已下线)课时53 简单实验方案的设计与评价-2022年高考化学一轮复习小题多维练(全国通用)四川省眉山市彭山区第一中学2021-2022学年高二上学期入学考试化学试题四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题(已下线)专题13 化学实验-备战2022年高考化学学霸纠错(全国通用)(已下线)第29讲 常见气体的制备与性质实验(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)2021年高考全国乙卷化学试题变式题(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-练习陕西省西北农林科技大学附属中学2021-2022学年高一上学期期末考试化学试题(已下线)秘籍04 实验仪器使用与基本操作-备战2022年高考化学抢分秘籍(全国通用)(已下线)卷01 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押全国卷理综第9题 化学实验基础-备战2022年高考化学临考题号押题(课标全国卷)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题11 基本实验专练(已下线)专题11化学实验基础-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题11化学实验基础-五年(2018~2022)高考真题汇编(全国卷)(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(练)-2023年高考化学一轮复习讲练测(全国通用)安徽省砀山县第四中学2022-2023学年高三上学期第一次月考化学试题(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)安徽省亳州市第五完全中学2021-2022学年高三上学期期中考试化学试题甘肃省张掖市高台县第一中学2022-2023学年高一上学期期中考试化学试题湖南省郴州市汝城县第一中学2022-2023学年高一上学期期中考试化学试题山西省实验中学2021-2022学年高二上学期开学考试化学试题安徽省六安市裕安区新安中学2022-2023学年高三上学期第三次月考化学试题(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价第四章 非金属及其化合物 第24讲 常见气体的实验室制备、净化和收集(已下线)素养卷07 微型物质制备方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题04 常见气体的实验室制取(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)(已下线)微专题 常见气体的实验室制备、净化和收集(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)云南省开远市第一中学校2023-2024学年高一上学期9月半月考试化学试题(已下线)第3讲 物质制备实验的设计与评价章末知识整合黑龙江省大庆市肇州县第二中学2023-2024学年高三上学期11月月考化学试题吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷
名校
解题方法
7 . 亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。
已知:HNO2既有氧化性又有还原性;AgNO2微溶于水,能溶于硝酸:AgNO2+HNO3= AgNO3+ HNO2。
(1)利用Ⅰ、Ⅱ、Ⅲ装置制备原料气NO和Cl2_____ 。
②利用上述装置制备NO时,Ⅱ中盛装物质为_________ (写化学式)。
(2)利用如图装置在常温常压下制备ClNO________ (按气流自左向右方向,用小写字母表示)。
②为使NO和Cl2恰好完全反应生成ClNO,理论上通入NO和Cl2两种气体的流速比为____ 。
③装置Ⅸ的作用是___________ 。
④ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,产生“气泡”的化学方程式为________ 。生成ClO2的反应属于歧化反应,每生成0.4 mol ClO2消耗NaClO2的量为_____ mol;
已知:HNO2既有氧化性又有还原性;AgNO2微溶于水,能溶于硝酸:AgNO2+HNO3= AgNO3+ HNO2。
(1)利用Ⅰ、Ⅱ、Ⅲ装置制备原料气NO和Cl2

②利用上述装置制备NO时,Ⅱ中盛装物质为
(2)利用如图装置在常温常压下制备ClNO

②为使NO和Cl2恰好完全反应生成ClNO,理论上通入NO和Cl2两种气体的流速比为
③装置Ⅸ的作用是
④ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,产生“气泡”的化学方程式为
您最近一年使用:0次
2020-11-09更新
|
259次组卷
|
2卷引用:宁夏青铜峡市高级中学2021届高三上学期期中考试化学试题



