解题方法
1 . 铁及其化合物在生产、生活中有重要作用。回答下列问题:
I.硫酸亚铁晶体 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:

(1)证明经步骤①得到的滤液中含有 的方法如下:取样,先滴加
的方法如下:取样,先滴加___________ ,再滴加少量氯水,该过程的现象为___________ 。
(2)步骤②加入氯水发生反应的离子方程式是___________ 。
(3)步骤③产生的红褐色物质成分是___________ (写化学式)。
(4)步骤④中一系列操作为___________ 、洗涤、干燥、灼烧。
(5)若所取补血剂质量为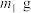 ,最终得到红棕色固体C的质量为
,最终得到红棕色固体C的质量为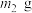 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为___________ (用含 、
、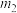 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。
II.高铁酸钾 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:

(6)过程①制取1mol ,理论上需要
,理论上需要 物质的量为
物质的量为___________ ,步骤②中反应能够发生的原因是___________ ,分离出 固体的操作中使用的玻璃仪器有
固体的操作中使用的玻璃仪器有___________ 。
I.硫酸亚铁晶体
 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
(1)证明经步骤①得到的滤液中含有
 的方法如下:取样,先滴加
的方法如下:取样,先滴加(2)步骤②加入氯水发生反应的离子方程式是
(3)步骤③产生的红褐色物质成分是
(4)步骤④中一系列操作为
(5)若所取补血剂质量为
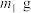 ,最终得到红棕色固体C的质量为
,最终得到红棕色固体C的质量为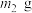 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为 、
、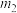 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。II.高铁酸钾
 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
(6)过程①制取1mol
 ,理论上需要
,理论上需要 物质的量为
物质的量为 固体的操作中使用的玻璃仪器有
固体的操作中使用的玻璃仪器有
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为_______ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。
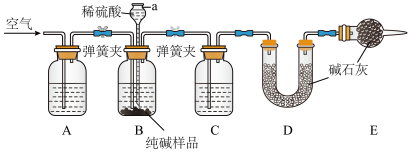
(2)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若_______ ,说明装置不漏气。
(3)装置A中的试剂为_______ ,装置C中的试剂为_______ 。装置E的作用是_______ 。
(4)实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为_______ (保留一位小数);若缺少E装置,会使测定结果_______ (填“偏高”或“偏低”)。

已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。

(2)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若
(3)装置A中的试剂为
(4)实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
2023-11-26更新
|
222次组卷
|
3卷引用:山西省实验中学2023-2024学年高一上学期期中考试化学试题
3 . 在实验室采用如图装置制备气体,合理的是
| 化学试剂 | 制备的气体 | |
| A | 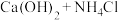 |  |
| B | 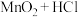 (浓) (浓) |  |
| C | 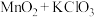 |  |
| D | 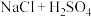 (浓) (浓) |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-09更新
|
21818次组卷
|
50卷引用:山西省实验中学2021-2022学年高二下学期开学分班素质测试化学试题
山西省实验中学2021-2022学年高二下学期开学分班素质测试化学试题山西省实验中学2021-2022学年高二上学期开学考试化学试题2021年高考全国乙卷化学真题河南省三门峡市实验高中2020-2021学年高二下学期6月月考化学试题河北省辛集中学 2020-2021学年高二下学期期末考试化学试题(已下线)第29讲 化学综合实验(精练)-2022年高考化学一轮复习讲练测(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时53 简单实验方案的设计与评价-2022年高考化学一轮复习小题多维练(全国通用)四川省眉山市彭山区第一中学2021-2022学年高二上学期入学考试化学试题宁夏中卫市中宁县第一中学2021-2022学年高三上学期第一次月考化学试题四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题(已下线)专题13 化学实验-备战2022年高考化学学霸纠错(全国通用)(已下线)第29讲 常见气体的制备与性质实验(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)2021年高考全国乙卷化学试题变式题(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-练习陕西省西北农林科技大学附属中学2021-2022学年高一上学期期末考试化学试题(已下线)秘籍04 实验仪器使用与基本操作-备战2022年高考化学抢分秘籍(全国通用)(已下线)卷01 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押全国卷理综第9题 化学实验基础-备战2022年高考化学临考题号押题(课标全国卷)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题11 基本实验专练(已下线)专题11化学实验基础-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题11化学实验基础-五年(2018~2022)高考真题汇编(全国卷)(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(练)-2023年高考化学一轮复习讲练测(全国通用)安徽省砀山县第四中学2022-2023学年高三上学期第一次月考化学试题(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)安徽省亳州市第五完全中学2021-2022学年高三上学期期中考试化学试题甘肃省张掖市高台县第一中学2022-2023学年高一上学期期中考试化学试题湖南省郴州市汝城县第一中学2022-2023学年高一上学期期中考试化学试题安徽省六安市裕安区新安中学2022-2023学年高三上学期第三次月考化学试题(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价第四章 非金属及其化合物 第24讲 常见气体的实验室制备、净化和收集(已下线)素养卷07 微型物质制备方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题04 常见气体的实验室制取(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)(已下线)微专题 常见气体的实验室制备、净化和收集(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)云南省开远市第一中学校2023-2024学年高一上学期9月半月考试化学试题(已下线)第3讲 物质制备实验的设计与评价章末知识整合黑龙江省大庆市肇州县第二中学2023-2024学年高三上学期11月月考化学试题吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷
4 . I.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,还可以作为贵金属的萃取剂。可由硫和氯气在100~110℃直接化合而成。实验室用以下装置制备S2Cl2并对尾气进行回收利用。已知S2Cl2的熔点:-77℃,沸点:137℃。S2Cl2遇水剧烈反应。
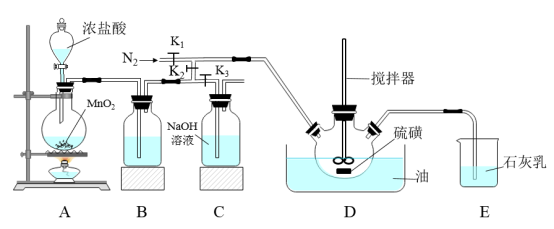
(1)B中所装试剂名称为______
(2)S2Cl2遇水会生成一种黄色单质、一种能使品红褪色的气体(化合物)及酸雾,写出该反应的化学方程式______ 。
(3)A、B装置中的空气可以通过控制K2、K3来去除,具体方法为______ ,写出E中发生的氧化还原的化学方程式______
(4)由于存在系统缺陷,实验制得的二氯化二硫可能不纯,故需增加一个盛有固体试剂的装置克服缺陷,则装置中的试剂可以选用______ 。
A. CaCl2 B.碱石灰 C.五氧化二磷 D.浓硫酸
II.氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中AlN的含量,某实验小组设计了如下实验方案。
已知: AlN+NaOH+H2O=NaAlO2+NH3↑
按以下步骤测定样品中AlN的纯度:

(5)步骤②生成沉淀的离子方程式为______ 。
(6)AlN的纯度是______ (用m1、 m2表示)。

(1)B中所装试剂名称为
(2)S2Cl2遇水会生成一种黄色单质、一种能使品红褪色的气体(化合物)及酸雾,写出该反应的化学方程式
(3)A、B装置中的空气可以通过控制K2、K3来去除,具体方法为
(4)由于存在系统缺陷,实验制得的二氯化二硫可能不纯,故需增加一个盛有固体试剂的装置克服缺陷,则装置中的试剂可以选用
A. CaCl2 B.碱石灰 C.五氧化二磷 D.浓硫酸
II.氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中AlN的含量,某实验小组设计了如下实验方案。
已知: AlN+NaOH+H2O=NaAlO2+NH3↑
按以下步骤测定样品中AlN的纯度:

(5)步骤②生成沉淀的离子方程式为
(6)AlN的纯度是
您最近一年使用:0次
名校
5 . 新冠疫情期间使用了大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
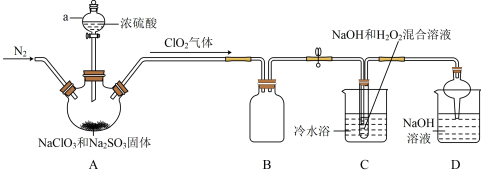
I.查阅资料:
①ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
Ⅱ.制备与分离:
(1)实验加药品前应进行的实验操作是____ 。
(2)盛放NaClO3和Na2SO3固体的仪器名称是____ 。
(3)装置A中参加反应的氧化剂与还原剂的物质的量之比为____ 。
(4)B装置的作用是____ 。
(5)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②的内容。
①减压,55℃蒸发结晶; ②____ ;
③用38℃~60℃热水洗涤; ④在38℃~60℃间进行干燥,得到成品。
(6)装置D是处理尾气,反应的化学方程式____ 。
(7)实验结束后,继续通入一段时间N2的目的是____ 。
Ⅲ.测量与计算:
(8)利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.4450g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,(已知:ClO +4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
①滴定终点的现象是____ 。
②下列滴定操作会导致测量结果偏低的是____ (填字母)。
a 锥形瓶洗涤后没有干燥 b 滴定时锥形瓶中有液体溅出
c 滴定终点时俯视读数 d 滴定管滴定前有气泡,滴定后气泡消失
③样品中NaClO2·3H2O的纯度为____ %(用含c、v的代数式表示)。

I.查阅资料:
①ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
Ⅱ.制备与分离:
(1)实验加药品前应进行的实验操作是
(2)盛放NaClO3和Na2SO3固体的仪器名称是
(3)装置A中参加反应的氧化剂与还原剂的物质的量之比为
(4)B装置的作用是
(5)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②的内容。
①减压,55℃蒸发结晶; ②
③用38℃~60℃热水洗涤; ④在38℃~60℃间进行干燥,得到成品。
(6)装置D是处理尾气,反应的化学方程式
(7)实验结束后,继续通入一段时间N2的目的是
Ⅲ.测量与计算:
(8)利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.4450g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。①滴定终点的现象是
②下列滴定操作会导致测量结果偏低的是
a 锥形瓶洗涤后没有干燥 b 滴定时锥形瓶中有液体溅出
c 滴定终点时俯视读数 d 滴定管滴定前有气泡,滴定后气泡消失
③样品中NaClO2·3H2O的纯度为
您最近一年使用:0次
2020-11-20更新
|
1050次组卷
|
3卷引用:山西省怀仁市第一中学2022届高三上学期第一次月考理科综合化学试题



